Продукция
Препараты зарегистрированные в Украине
Патогенетические подходы к устранению диспептического синдрома при панкреатической недостаточности
Н.Б. Губергриц, В.А. Гирман
Донецкий национальный медицинский университет им. М. Горького
Эпидемиологические показатели заболеваний поджелудочной железы (ПЖ) в Украине за последние годы значительно ухудшились: удельный вес данной патологии в структуре заболеваний органов пищеварения достигает 10,5%. При этом возрастает частота хронического панкреатита (ХП) у молодых людей и детей, наблюдаются высокая частота сочетанной патологии, упорное рецидивирующее течение заболевания, резистентность к медикаментозной терапии. Тяжелый болевой синдром и прогрессирующая функциональная недостаточность ПЖ нередко приводят к инвалидизации пациентов.
ХП способствует значительному ухудшению качества жизни, что обусловлено как тяжестью клинических проявлений заболевания, снижением функционального состояния ПЖ, так и повышенным риском трансформации в злокачественный процесс. Осложнения ХП часто приводят к летальному исходу. Существенной причиной снижения качества жизни больных ХП является внешнесекреторная недостаточность ПЖ, которая клинически проявляется прежде всего симптомами желудочной и кишечной диспепсии.
Для разработки патогенетического подхода к купированию диспептического синдрома при ХП необходимо понимание его патогенеза. При уменьшении количества функционально активных ацинарных клеток ПЖ (в случае атрофии, фиброза) последняя не может обеспечить поступление в двенадцатиперстную кишку (ДПК) количества ферментов, необходимого для полного гидролиза нутриентов. Негидролизованные нутриенты задерживаются в ДПК. Данный механизм основывается на временном факторе: ожидается, что панкреатические ферменты, поступающие в недостаточном количестве, в течение некоторого времени будут накоплены в необходимом объеме и обеспечат гидролиз компонентов химуса. Именно таким путем формируются дуоденостаз и дуоденальная гипертензия при ХП с внешнесекреторной недостаточностью ПЖ, клиническими проявлениями которых являются симптомы диспепсии — тяжесть, ощущение распирания, дискомфорт в верхних отделах живота (рис. 1). Кроме того, дуоденостаз рефлекторным путем вызывает возбуждение рвотного центра для снижения давления в ДПК, что приводит к тошноте и рвоте, не приносящим облегчения. Рефлекторному возбуждению рвотного центра способствуют также растяжение стенок главного панкреатического протока (характерно для обструктивного панкреатита), общего желчного протока (например, в случае желчнокаменной болезни при билиарном ХП), интоксикация, типичная для обострения панкреатита. В результате тошнота усиливается, увеличивается вероятность рвоты (рис. 1).
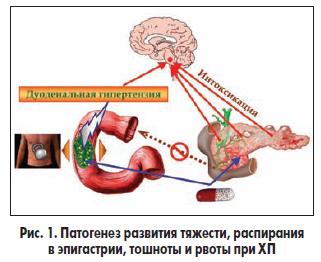
С учетом вышеописанных патогенетических механизмов диспепсии становится очевидным, что основной путь ее устранения — назначение полиферментного препарата в форме покрытых кишечнорастворимой оболочкой минимикросфер в желатиновых капсулах как «золотого» стандарта ферментной терапии (рис. 1). Эвакуировавшись в ДПК из желудка вместе с химусом, минимикросферы полиферментного препарата обеспечивают быстрый и полный гидролиз компонентов этого химуса в ДПК, что будет способствовать ликвидации дуоденостаза. При использовании таблетированных ферментных препаратов вследствие асинхронизма последние задержатся в желудке, а химус, попавший в ДПК, по-прежнему будет «ожидать» ферменты для гидролиза и дальнейшей эвакуации в тонкую кишку. Конечно, с учетом патогенеза уменьшению выраженности тяжести в эпигастрии, тошноты, рвоты должно способствовать и применение комбинации полиферментного препарата в форме покрытых кишечнорастворимой оболочкой минимикросфер в желатиновых капсулах с прокинетиками, которые будут действовать «с другой стороны» (влиять на моторику, нормализовывая перистальтику).
На кафедре внутренней медицины им. профессора А.Я. Губергрица для лечения ХП давно применяется домперидон, однако оригинальный препарат имеет высокую стоимость, что особенно важно с учетом необходимости длительного приема. Применение Моторикса более целесообразно с экономической точки зрения.
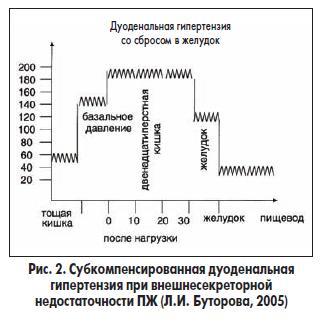
Дуоденостаз у больных ХП нередко является причиной не только компенсированной, но суб- и даже декомпенсированной дуоденальной гипертензии. Гиперфункция мышечных образований клапанных структур сменяется их недостаточностью, вначале относительной, а затем абсолютной. Происходит регургитация дуоденального содержимого в органы, которые связаны с ДПК выводными протоками или прямым сообщением (рис. 2). Рефлюкс в вирсунгов проток приводит к усугублению ХП (энтерокиназа, попадая в ПЖ, вызывает внутриорганную активацию трипсиногена); рефлюкс в общий желчный проток приводит к развитию холецистита; рефлюкс в желудок, а затем и в пищевод — к формированию рефлюкс-гастрита, желчного дуоденогастроэзофагеального рефлюкса, может способствовать развитию диафрагмальной грыжи, которая встречается при ХП достаточно часто. В случае суб- или декомпенсации дуоденальной гипертензии, кроме полиферментного препарата в желатиновых капсулах, обоснованным будет назначение прокинетиков, урсодезоксихолевой кислоты, препаратов, защищающих слизистую пищевода (альгиновой кислоты). Рефлюксные явления клинически проявляются отрыжкой, изжогой.
Рассмотрим физиологические взаимосвязи между ДПК и желудком. В этом отношении необходимо вспомнить о двух рефлексах, регулирующих взаимоотношения моторики желудка и ДПК. Первый из этих рефлексов — энтерогастритический: растяжение ДПК после поступления в нее содержимого из желудка выключает моторику желудка, что сопровождается закрытием привратника и стимуляцией дуоденальной моторики. Этот рефлекс был описан С.И. Линтваревым в лаборатории И.П. Павлова и назван дуоденопилорическим запирательным рефлексом. Так, С.И. Линтварев показал, что замедление эвакуации из желудка при приеме жирной пищи является результатом этого запирательного рефлекса, так как жирная пища требует более длительного воздействия липазы в ДПК. В.Н. Болдырев наблюдал регургитацию дуоденального содержимого в желудок, при которой панкреатическая липаза попадает в желудок и там участвует в начальном переваривании жира. Это является еще одной причиной замедленной эвакуации жирной пищи из желудка в ДПК. Из-за дефицита липазы при ХП гидролиз жира в ДПК замедляется, снижается эффективность физиологического дуоденогастрального рефлюкса для начального переваривания жира, что и приводит к замедлению эвакуации содержимого желудка при внешнесекреторной недостаточности ПЖ у больных ХП, способствуя усугублению тяжести, распирания в эпигастрии. Корригировать эти патогенетические механизмы можно путем применения комбинации полиферментного препарата в желатиновых капсулах и прокинетиков, что способствует своевременному поступлению панкреатина в ДПК. Высокая активность липазы в ДПК при лечении полиферментным препаратом в желатиновых капсулах улучшает, а иногда и позволяет достичь физиологического уровня дуоденогастрального рефлюкса липазы, при этом липаза не инактивируется, так как находящийся в желудке химус уже в значительной мере нейтрализовал соляную кислоту.
При ХП развивается не только желудочная, но и кишечная диспепсия. При растяжении илеального отдела тонкой кишки, что характерно для внешнесекреторной недостаточности ПЖ, значительно угнетается моторная активность ДПК и желудка (рис. 3). Этот рефлекс называют илеальным торможением желудочной и дуоденальной моторики. Его включение при внешнесекреторной недостаточности ПЖ вносит свой вклад в замедление эвакуации из верхних отделов пищеварительного тракта и усугубление дуоденостаза.
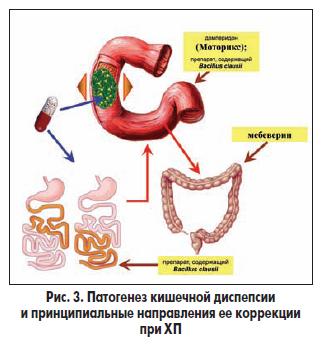
Известно о наличии рефлекса активации моторики толстой кишки, связанного с раздражением механорецепторов желудка и ДПК, реагирующих на растяжение химусом. Эти взаимосвязи при замедлении эвакуации из желудка и при наличии дуоденостаза в условиях внешнесекреторной недостаточности ПЖ способствуют возникновению нарушений стула.
Вследствие панкреатической недостаточности недорасщепленные нутриенты, поступая в тонкую кишку, подвергаются гниению и брожению, что сопровождается метеоризмом, флатуленцией. Кроме того, на фоне уменьшения содержания панкреатических ферментов в ДПК снижается барьерная функция последней, что приводит к формированию синдрома избыточного бактериального роста (СИБР); питательной средой для бактерий выступают недостаточно гидролизованные компоненты химуса. СИБР, в свою очередь, вносит свой вклад в кишечную диспепсию. Следовательно, необходимо назначение препарата, обладающего свойствами кишечного антисептика.
Наше внимание в этом отношении привлекли препараты, содержащие Bacillus clausii, обладающие одновременно противомикробными и пробиотическими свойствами. Кроме того, Bacillus clausii производит энзимы, которые также участвуют в улучшении процесса пищеварения. Таким образом, можно избежать назначения двух препаратов (кишечного антисептика, а затем пробиотика) и ввести в пищеварительный тракт микробные ферменты, которые обладают стабильностью в кислой среде. Причем важна толерантность бактериальной липазы не только к кислой среде желудка пациента, но и к закислению дуоденального содержимого при снижении продукции бикарбонатов ПЖ в случае выраженной внешнесекреторной недостаточности ПЖ. Для бактериальных ферментов характерны широкая субстратная специфичность; устойчивость к протеазам, снижающим активность липазы, и к ингибиторам ферментов ПЖ человека и животных; отсутствие подавляющего влияния на секреторную функцию ПЖ. Немаловажным является также тот факт, что Bacillus clausii принимает участие в синтезе витамина B2, аминокислот (в т. ч. незаменимых: треонина, глутаминовой кислоты, аланина, валина, тирозина, гистидина, орнитина и др.), которые, безусловно, необходимы при панкреатической недостаточности.
Таким образом, в патогенезе диспепсии при ХП главную роль играет дуоденостаз. Не случайно даже в научной медицинской литературе дуоденостаз называют «дуоденальным демоном» (рис. 4). Синдром дуоденальной гипертензии проявляется целым рядом диспептических расстройств: тяжестью в эпигастрии, отрыжкой, изжогой, тошнотой, рвотой, метеоризмом, нарушениями стула. Однако этим симптомокомплекс не ограничивается. Диспепсия часто дополняется явлениями психосоматической астенизации, снижением работоспособности, апатией и проч. Для дуоденальной гипертензии характерна также головная боль по типу мигрени («дуоденальная мигрень»), патогенез которой, вероятно, носит нервно-рефлекторный характер в ответ на активацию вагальных и нервных симпатических афферентных импульсов при растяжении ДПК.
На основании вышеизложенного описания патогенеза диспепсии при панкреатической недостаточности понятно, что основными направлениями купирования диспептических жалоб при ХП являются:
- ликвидация явлений стаза в ДПК;
- ускорение эвакуации из желудка;
- устранение СИБР в тонкой кишке.
Целью исследования было оценить эффективность патогенетической терапии диспептического синдрома у больных ХП с недостаточностью ПЖ.
Материалы и методы
Обследованы 62 больных ХП (34 (54,8%) женщины и 28 (45,2%) мужчин), возраст которых составил от 27 до 63 лет. Диагноз подтверждали при наличии типичной клинической картины ХП, феномена «уклонения» ферментов в кровь (контролировали по показателям активности альфа-амилазы, панкреатической изоамилазы, липазы крови), характерных изменений ПЖ по данным сонографии.
Выраженность субъективных проявлений оценивали до и после лечения с помощью показателя средней степени тяжести (ССТ) с использованием полуколичественной шкалы: 0 баллов — жалобы отсутствуют; 1 балл — жалобы минимальны; 2 балла — жалобы умеренные; 3 балла — жалобы выраженные или очень выраженные.
.jpg)
- где ССТ — средняя степень тяжести клинических проявлений;
- а — количество больных с выраженностью признака в 1 балл;
- b — количество больных с выраженностью признака в 2 балла;
- c — количество больных с выраженностью признака в 3 балла;
- d — количество больных с отсутствием признака.
Внешнесекреторную недостаточность ПЖ диагностировали до лечения по результатам эластазного теста (определение фекальной эластазы-1). Тест выполняли и после лечения для оценки динамики функционального состояния ПЖ.
Для оценки скорости эвакуации из желудка выполняли 13С-октановый дыхательный тест до и после лечения (исследование выполняли натощак; после получения исходной дыхательной пробы пациент съедал тестовый завтрак — яичницу-болтунью, в которой растворено 75 мг 13С-октановой кислоты, пшеничный хлеб с маргарином и 200 мл минеральной воды без газа; дыхательные пробы проводили после завтрака через каждые 15 мин в течение 4 ч).
Для диагностики СИБР в тонкой кишке до и после лечения проводили водородный дыхательный тест: пациенты принимали 10 г лактулозы утром натощак после обработки полости рта антисептиком. Выдыхаемый водород измеряли перед проведением теста и через 20, 40, 60, 80, 100, 120, 150 и 180 мин.
Больные были разделены на 2 группы. В основную вошли 32 (51,6%) пациента, в группу сравнения — 30 (48,4%) больных. Пациентам основной группы назначали стандартную терапию ХП (антисекреторные средства, инфузионную терапию, при необходимости — антибиотики, анальгетики; в качестве ферментного препарата — полиферментный препарат в форме покрытых кишечнорастворимой оболочкой минимикросфер в желатиновых капсулах), а также домперидон (Моторикс) по 10 мг 3 р/день за 15–20 мин до еды и препарат, содержащий Bacillus clausii, — по одному флакону 3 р/день между приемами пищи (через равные промежутки времени) в течение 3 нед.
Больные группы сравнения получали только стандартную терапию.
Обследованы 30 практически здоровых лиц, которые были сопоставимы с больными по полу и возрасту (контрольная группа).
Результаты и обсуждение
Основной жалобой у всех обследованных нами лиц была боль в животе. 37 (59,7%) больных оценивали ее как интенсивную, 20 (32,3%) пациентов — как умеренную и 5 (8,0%) — как минимальную. ССТ болевого синдрома составила 2,52.
Все пациенты в качестве фактора, провоцирующего боль, отмечали прием пищи. У 39 (62,9%) обследованных боль была постоянной и после еды усиливалась, а у остальных 23 (37,1%) — периодической, то есть возникала только после еды. Усиление или возникновение боли через 20–30 мин после еды отмечалось у 41 (66,1%) больного, через 30–40 мин — у 15 (24,2%); значительно реже боли возникали или усиливались через 10–20 мин после еды у 6 (9,7%) пациентов. У 9 (14,5%) больных боли провоцировались приемом любой пищи независимо от ее характера и объема, остальные пациенты отмечали возникновение/усиление боли после употребления острой, жареной, жирной пищи. 16 (25,8%) пациентов указывали, что чем больше объем принятой пищи, тем вероятнее появление болевого синдрома.
Все больные указывали на боль в левом подреберье. Однако только у 17 (27,4%) из них боли локализовались исключительно в левом подреберье. Несколько чаще отмечалась локализация болей в эпигастрии и левом подреберье — у 21 (33,9%) пациента. Наиболее типичной была локализация боли в эпигастрии, в правом и левом подреберьях, что имело место у 24 (38,7%) больных.
27 (43,5%) пациентов отмечали иррадиацию болей по типу «полного пояса» (в поясничном отделе). Несколько реже наблюдалась иррадиация по типу «левого полупояса» — у 23 (37,1%) больных. Наиболее редкой была иррадиация по типу «правого полупояса» — у 12 (19,4%) больных. Кроме того, 9 (14,5%) пациентов указывали на иррадиацию болей в предсердечную область, 11 (17,7%) больных — в левую ключицу и/или в левое плечо, 7 (11,3%) пациентов — под левую лопатку. У 28 (45,2%) больных отмечалась типичная для билиарной патологии иррадиация боли — в правую ключицу и/или под правую лопатку, и/или в правое плечо, и/или в правую половину шеи.
Большинство обследованных отмечали уменьшение боли при голодании (41 (66,1%) пациент), при прикладывании холода на левое подреберье (38 (61,3%)), при приеме спазмолитиков (35 (56,5%) пациентов).
Кроме болей, характерными были тяжесть, дискомфорт, ощущение распирания в верхнем отделе живота. Такие жалобы имели место у 27 (43,6%) больных.
Всех больных беспокоили диспептические явления. Выраженные диспептические явления отмечали 39 (62,9%) больных, умеренные — 18 (29,1%), минимальные — 5 (8,0%) пациентов. ССТ диспепсии составила 2,55.
Наиболее частым проявлением диспепсии были тошнота, постпрандиальная тяжесть в верхнем отделе живота, на которые указывали 32 (51,6%) больных. Характерными также были горечь во рту (у 28 (45,2%) обследованных), отрыжка воздухом или съеденной пищей (у 27 (43,5%) пациентов), метеоризм (у 22 (35,5%) участников), изжога (у 21 (33,9%) больного). Реже отмечалась рвота, не приносящая облегчения (у 14 (22,6%) больных). Имели место нарушения стула: у 19 (30,6%) пациентов — склонность к послаблению стула и диарее, у 15 (24,2%) — склонность к запорам, у 18 (29,1%) — чередование поносов и запоров; и только у 10 (16,1%) обследованных стул был нормальным. Также 52 (83,9%) больных указывали на общую слабость, 9 (14,5%) — на снижение массы тела, 6 (9,7%) — на повышение температуры до субфебрильных цифр, преимущественно по вечерам.
Все больные находились в удовлетворительном состоянии. У 54 (87,1%) пациентов определялась субиктеричность или легкая иктеричность кожи и слизистых. У 48 (77,4%) больных язык был обложен беловатым, сероватым или желтоватым налетом; у 37 (59,7%) участников выявлены отпечатки зубов по краям языка.
Не зафиксировано ни одного случая увеличения периферических лимфоузлов. При объективном обследовании органов грудной клетки изменений не выявлено (за исключением таковых у больных, страдавших сопутствующими хроническим бронхитом, ишемической болезнью сердца, артериальной гипертензией).
При поверхностной пальпации болезненность в левом подреберье определялась у 5 (80,1%) пациентов. При глубокой пальпации болезненность в проекции ПЖ имела место у всех обследованных, причем у 7 (11,3%) пациентов пальпировалась болезненная ПЖ в виде поперечно расположенного тяжа.
Болезненность в проекции всей ПЖ при пальпации выявлена у 6 (9,7%) больных, преимущественно в проекции головки ПЖ — у 19 (30,6%) пациентов, преимущественно в проекции тела ПЖ — у 13 (21,0%) больных. У остальных 24 (38,7%) участников определялась отчетливая болезненность в проекции головки и тела ПЖ.
Мы оценивали также болезненность в зонах и точках, характерных для ХП. Оказалось, что болезненность в зоне Шоффара определялась у 47 (75,8%) больных, в зоне М. Губергрица-Скульского — у 35 (56,5%) пациентов, в точке Дежардена — у 48 (77,4%) участников, в точке А. Губергрица — у 17 (27,4%) больных.
При копроскопии у 4 (6,5%) больных обнаружена стеаторея; поскольку последняя характерна только для тяжелой панкреатической недостаточности, можно было предварительно судить о том, что таковая при ХП на фоне постхолецистэктомического синдрома встречается редко. Амилорея обнаружена у 3 (4,8%) больных, креаторея — у 4 (6,5%) пациентов.
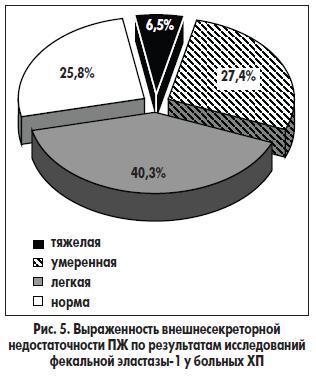
Редкость тяжелой внешнесекреторной недостаточности ПЖ была подтверждена и данными исследования показателей фекальной эластазы-1. Так, показатель <100 мкг/г был выявлен тоже у 4 (6,5%) больных. Таким совпадением данных копроскопии и фекального эластазного теста подтверждается высокая чувствительность последнего в диагностике именно тяжелой панкреатической недостаточности. Умеренное снижение внешней секреции ПЖ выявлено у 17 (27,4%) пациентов, легкое — у 25 (40,3%). У остальных 16 (25,8%) больных показатели эластазного теста оказались нормальными, что свидетельствует о сохранной внешнесекреторной функции ПЖ (рис. 5).
По данным 13С-октанового дыхательного теста у здоровых лиц во всех случаях коэффициент желудочного опорожнения от твердой пищи был >3,1, а время полувыведения содержимого из желудка — <130 мин. У 41 (66,1%) пациента с ХП отмечено умеренное снижение скорости опорожнения желудка (коэффициент опорожнения 3,12,5); в 19,4% случаев (у 12 больных) выявлено выраженное снижение скорости опорожнения желудка (коэффициент опорожнения >2,5); только в 14,5% случаев (у 9 пациентов) скорость опорожнения была нормальной. Результаты исследования времени полувыведения содержимого желудка у больных были соответствующими. Так, период полувыведения <130 мин определялся у 9 больных и всех здоровых, умеренное снижение периода полувыведения — у 41 пациента, выраженное снижение — у 12 больных.
Важно, что период полувыведения тестового завтрака из желудка обратно коррелировал с показателями фекальной эластазы-1 (коэффициент прямой корреляции составил 0,52).
Результаты 13С-октанового дыхательного теста приведены ниже в динамике в двух группах больных.
С помощью водородного дыхательного теста СИБР был выявлен у 54 (87,1%) пациентов.
Позитивная динамика болевого синдрома под влиянием лечения была более выражена у больных основной группы: боли исчезли у 7 (21,8%) пациентов, уменьшились у 21 (65,6%); выраженность болевого синдрома не изменилась у 2 (6,3%) больных,
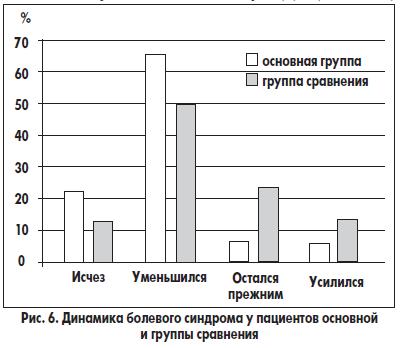
усилилась — у 2 (6,3%) больных. Среди больных группы сравнения боли исчезли у 4 (13,3%) обследованных, уменьшились у 15 (50,0%); выраженность болевого синдрома не изменилась у 7 (23,4%) пациентов, усилилась у 4 (13,3%). Таким образом, количество пациентов основной группы, у которых удалось купировать болевой синдром или уменьшить его выраженность, превышало таковое в группе сравнения в 1,6 и 1,3 раза соответственно. В то же время количество лиц основной группы, у которых выраженность болевого синдрома не изменилась и усилилась, было меньше такового в группе сравнения в 3,7 и 2,1 раза соответственно (рис. 6). ССТ болевого синдрома после лечения в основной группе составила 1,24, в то время как в группе сравнения — 1,58, то есть в 1,3 раза выше.
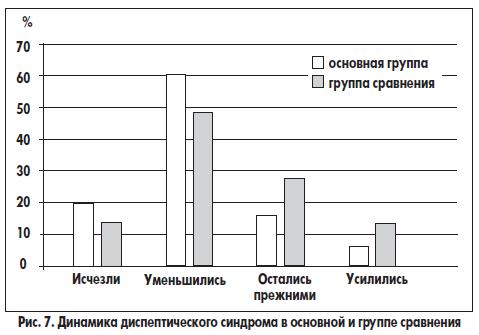
Диспептические явления исчезли у 6 (18,8%), их выраженность уменьшилась у 19 (59,4%), не изменилась у 5 (15,6%) и усилилась у 2 (6,2%) больных основной группы. Соответствующие показатели среди больных группы сравнения составили 4 (13,3%), 14 (46,7%), 8 (26,7%) и 4 (13,3%). Включение домперидона (Моторикса), полиферментного препарата в желатиновых капсулах и препарата, содержащего Bacillus clausii, в комплексную терапию ХП было более эффективным и в отношении влияния на диспептический синдром (рис. 7). ССТ диспепсии после лечения в основной группе составила 1,18, а в группе сравнения — 1,42. Особенно отчетливые преимущества в этом плане были найдены в отношении таких симптомов, как тошнота и тяжесть в эпигастрии после еды. Исчезновение жалоб к моменту выписки из клиники отметили 11 (73,3%) из 15 больных основной группы и 10 (58,8%) из 17 пациентов группы сравнения.
Стандартная терапия с дополнительным использованием препарата Моторикс и пробиотика также эффективно влияла на явления кишечной диспепсии. После проведенного лечения явления метеоризма исчезли у 10 (83,3%) больных основной группы и только у 5 (50,0%) пациентов группы сравнения, диареи — у 10 (90,9%) пациентов основной группы и только у 5 (62,5%) больных группы сравнения. У 8 (88,9%) больных основной группы и у 4 (44,4%) пациентов группы сравнения, у которых до лечения имело место чередование запоров и поносов, стул стал стабильным, оформленным. Запоры исчезли у 5 (71,4%) пациентов основной группы и у 4 (50,0%) лиц группы сравнения. Таким образом, эффективность лечения, использовавшегося в основной группе, в отношении метеоризма была в 1,7 раза выше, в отношении диареи — в 1,5 раз выше, в отношении неустойчивого стула — в 2,0 раза выше, в отношении запоров — в 1,4 раза выше.
Важно отметить, что все больные, у которых, несмотря на лечение, имело место усиление болевого и диспептического синдрома, грубо нарушали диету.
Болезненность при пальпации исчезла или уменьшилась у 24 (75,0%) больных основной группы и у 16 (53,3%) участников из группы сравнения, что также подтверждает целесообразность использования домперидона (Моторикса) и препарата, содержащего Bacillus clausii, при лечении ХП (рис. 8).
Улучшение показателей копроскопии было сходным и сопоставимым у больных обеих групп. Такой отчетливый и сходный при обоих вариантах терапии результат мы связываем с тем, что все участники исследования получали базисные средства, важнейшим компонентом которых являлся полиферментный препарат в форме покрытых кишечнорастворимой оболочкой минимикросфер в желатиновых капсулах. Это способствовало ликвидации мальдигестии у всех больных, у которых при поступлении в клинику выявляли стеаторею (4 пациента), амилорею (3 больных) и креаторею (4 пациента).
При анализе динамики показателей фекальной эластазы-1 было выявлено, что у пациентов основной группы по результатам эластазного теста внешнесекреторная функция ПЖ улучшалась под влиянием лечения более выраженно, чем у больных группы сравнения. Так, если до лечения нормальное содержание эластазы-1 в кале определялось у 8 (25,0%) больных основной группы и у 8 (26,7%) пациентов группы сравнения, то после лечения эти показатели составили соответственно 12 (37,5%) и 10 (33,3%). После лечения частота легкой панкреатической недостаточности составила 37,5% (12 пациентов) в основной группе и 36,7% (11 больных) в группе сравнения. Частота встречаемости умеренной панкреатической недостаточности составила соответственно 18,7% (6 больных) и 23,3% (7 пациентов), а частота встречаемости тяжелой панкреатической недостаточности соответствовала таковой до лечения. В частности, в основную группу вошли 2 (6,3%) пациента, у которых показатели фекальной эластазы-1 составляли <100 мкг/г. После лечения у этих больных результаты эластазного теста остались низкими, то есть сохранялась тяжелая внешнесекреторная недостаточность ПЖ. Аналогичная ситуация отмечена и в группе сравнения, куда вошли 2 (6,7%) участника с выраженной панкреатической недостаточностью; перед выпиской из клиники у них наблюдались низкие показатели эластазного теста (рис. 9).
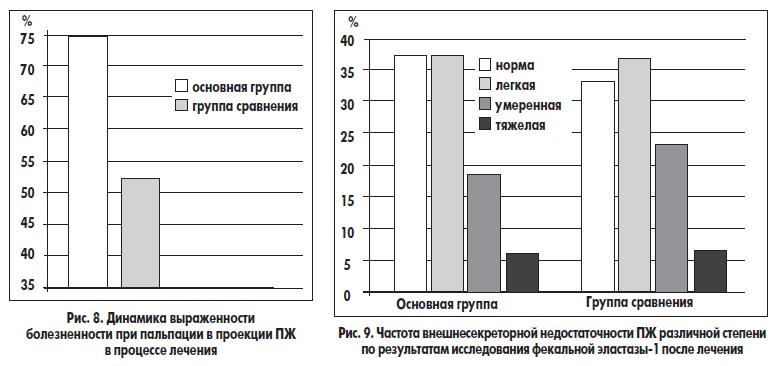
Число пациентов в основной группе, у которых наблюдался нормальный уровень фекальной эластазы-1 перед выпиской из клиники, превышало таковое в группе сравнения на 4,2%. Перед выпиской из клиники частота легкой панкреатической недостаточности по данным изучения фекальной эластазы-1 в основной группе составила 37,5% (12 больных) и в группе сравнения — 36,7% (11 пациентов). Уменьшение частоты встречаемости легкой недостаточности ПЖ под влиянием лечения произошло в обеих группах за счет того, что у 4 больных основной группы и у 2 участников группы сравнения удалось достичь нормализации данных эластазного теста. Таким образом, частота подобной нормализации в основной группе наблюдалась в 2 раза чаще, чем в группе сравнения. Умеренная панкреатическая недостаточность после лечения встречалась реже у больных основной группы — в 18,7% случаев (у 6). В группе сравнения после лечения умеренная недостаточность ПЖ встречалась в 23,3% случаев (у 7 больных) (рис. 9), то есть при наличии исходно умеренного снижения внешнесекреторной функции ПЖ ее динамика была выражена меньше по сравнению с динамикой легкой панкреатической недостаточности. По нашим данным, динамика панкреатической недостаточности от умеренной до легкой под влиянием терапии наблюдалась у 3 больных основной группы и только у 1 пациента группы сравнения. В результате частота умеренного снижения внешней секреции ПЖ перед выпиской среди больных группы сравнения была в 1,2 раза выше, чем в основной группе. В итоге нормальные показатели эластазного теста и легкое их снижение после лечения выявлялись у 75,0% больных основной группы и у 70,0% группы сравнения. Частота умеренной и тяжелой панкреатической недостаточности после лечения, напротив, была выше в группе сравнения — 30,0% против 25,0% у пациентов основной группы.
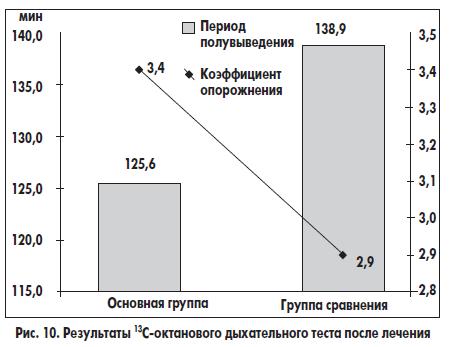
При проведении 13С-октанового дыхательного теста после лечения в основной группе нормализация результатов наблюдалась у 22 (81,5%) из 27 больных с исходным замедлением эвакуации из желудка, вошедших в основную группу. В группе сравнения результаты дыхательного теста нормализовались у 15 (65,2%) из 23 больных. Таким образом, включение домперидона (Моторикса) и препарата, содержащего Bacillus clausii, в схему лечения больных ХП способствовало нормализации исходно замедленной эвакуации из желудка в 1,3 раза чаще, чем стандартная терапия. Средний коэффициент желудочного опорожнения до лечения в основной группе составил 2,7±0,2, а в группе сравнения — 2,6±0,1; после лечения соответственно 3,4±0,2 и 2,9±0,3 (по сравнению с первым исследованием р<0,05 и р>0,05 соответственно). Период полувыведения пищи из желудка при поступлении больных основной группы в клинику составил 148,4±6,7 мин, после лечения — 125,6±7,1 мин (р<0,05); в группе сравнения соответственно 145,0±7,1 и 138,9±8,3 мин (р>0,05). В основной группе достигнуто достоверное ускорение эвакуации из желудка, а в группе сравнения появилась только тенденция к улучшению показателей (рис. 10). В контрольной группе во всех случаях коэффициент опорожнения желудка составлял >3,1, а период полувыведения — <130 мин.
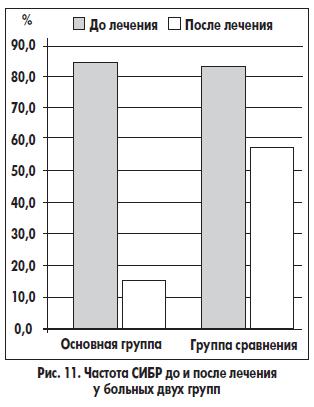
Пациенты с диагностированным с помощью водородного дыхательного теста СИБР распределились по группам следующим образом: 28 пациентов вошли в основную группу, остальные 26 — в группу сравнения. Таким образом, в основной группе СИБР диагностирован в 87,5% случаев, а в группе сравнения — в 86,7% случаев. По окончании лечения СИБР имел место у 6 (18,8%) больных основной группы и у 18 (60,0%) пациентов группы сравнения (рис. 11). Такая выраженная разница в результатах терапии связана с тем, что больные основной группы получали полиферментный препарат в желатиновых капсулах и препарат, содержащий Bacillus clausii, а пациенты группы сравнения — только полиферментный препарат в желатиновых капсулах, который, вероятно, способствовал снижению частоты СИБР вследствие уменьшения количества недостаточно гидролизованных компонентов химуса в тонкой кишке.
Выводы
- Включение домперидона (Моторикса) и препарата, содержащего Bacillus clausii, в состав стандартной терапии больных ХП (при условии использования полиферментного препарата в желатиновых капсулах) способствует уменьшению выраженности клинических проявлений заболевания. Отчетливые преимущества этого лечебного комплекса проявляются купированием болевого и диспептического синдромов, устранением симптомов кишечной диспепсии.
- Под влиянием лечения с использованием домперидона, препарата, содержащего Bacillus clausii, и полиферментного препарата в минимикросферах более существенно, чем при назначении только стандартной терапии, оптимизируется внешнесекреторная функция ПЖ (вероятно, это связано с более эффективным действием ферментного препарата при деконтаминации ДПК).
- Домперидон (Моторикс) достоверно ускоряет исходно замедленную эвакуацию из желудка у больных ХП.
- Дополнение традиционного лечения препаратом, содержащим Bacillus clausii, способствует эффективному устранению СИБР при внешнесекреторной недостаточности ПЖ.






