Продукция
Пономарёв В.В., Аркинд Г.Д., Щенснович А.Я.
Белорусская медицинская академия последипломного образования, Минск 21-я центральная районная поликлиника, Минск
Эффективность Тизалуда в комплексной терапии болей в нижней части спины
Заболевания периферической нервной системы в структуре неврологических заболеваний занимают второе место после цереброваскулярной патологии, являясь при этом ведущей причиной временной утраты трудоспособности. К практическим врачам-неврологам чаще обращаются пациенты, испытывающие боли в области спины, 40% из них испытывают хроническую боль (более 12 недель). Такая патология в современной литературе получила название дорсопатия и по МКБ-10 шифруется М40–М54 [1–5, 9]. Ей подвержены люди любого возраста и пола, однако преобладают лица молодого и наиболее трудоспособного возраста (20–50 лет), что придает проблеме медико-социальную значимость. По мнению экспертов ВОЗ, дорсопатии наряду с другими распространенными патологическими состояниями (остеопороз, остеоартроз) приводят к наибольшим экономическим потерям для населения [8]. По локализации среди всех дорсопатий преобладают пациенты с болями в нижней части спины (боль в пояснице – low back pain). Данная нозологическая форма проявляется болью, которая локализуется между XII парой ребер и складками ягодиц, но может иррадиировать в нижние конечности [6]. Причины такого частого поражения связаны со значительной функциональной нагрузкой, которая выпадает на поясничный отдел позвоночника [5, 7].
В настоящее время большинство специалистов признают, что дорсопатии являются полиэтиологическим заболеванием. В его патогенезе доказана роль нескольких факторов: 1) компрессионного (грыжа диска, дегенеративные изменения дугоотросчатых суставов, гипертрофированная желтая связка, остеофиты); 2) дисфиксационного (ослабление или повышение фиксации позвоночного двигательного сегмента); 3) дисгемического (нарушение кровообращения в зоне пораженного диска и корешка); 4) аутоиммунного воспаления [1, 2]. В зависимости от ведущего патогенетического механизма у пациентов с low back pain в разных сочетаниях встречаются болевой, мышечно-тонический, нейродистрофический и вегетативнососудистый синдромы [4–7]. Основное проявление заболевания – болевой синдром, и его быстрое купирование представляет первоочередную задачу для врачаневролога. Механизм болей у пациентов с low back pain связан в основном с раздражением рецепторов синувертебрального нерва Люшка, которым богато иннервировано фиброзное кольцо диска, и рефлекторным мышечным спазмом с локальной ишемией паравертебральных мышц. Оба патогенетических механизма взаимно отягощают друг друга, замыкая порочный круг, когда боль провоцирует мышечный спазм, который в свою очередь усугубляет боль [8].
Лечение этой патологии обачно проводится комплексно: с сочетанием медикаментозной и физиотерапии. В клинической практике максимальный обезболивающий и противовоспалительный эффект традиционно достигается применением медикаментов, обладающих способностью воздействовать на медиаторы воспаления в компонентах позвоночных двигательных сегментов [7]. Среди них наиболее распространены нестероидные противовоспалительные препараты (НПВП). Однако они вызывают такой побочный эффект, как НПВП-гастропатии, их частота может достигать 30% [6, 9]. В связи с этим актуален поиск «идеальной» группы препаратов для устранения болей в спине.
Исходя из полифакторного патогенеза дорсопатий и наличия у больных регионарного мышечного спазма в лечении данной патологии обосновано использование миорелаксантов. Выбор препарата с миорелаксирующим действием обачно происходит эмпирически на основании личного опыта врача. При лечении болей в спине доказана эффективность брендовых препаратов мидокалма и сирдалуда [4, 8, 9]. Однако повышение цен на основные группы медикаментов все чаще заставляет врача выбирать необходимый препарат из группы дженериков, болем дешевый при сравнимой эффективности. Среди миорелаксантов, представленнях на фармацевтическом рынке РБ, внимание специалистов привлек миорелаксант центрального действия Тизалуд (тизанидин). Он уменьшает мышечный спазм за счет угнетения спинномозговых полисинаптических рефлексов, что связано с высвобождением возбуждающих аминокислот из пресинаптических терминалей и спинальных мотонейронов. После приема внутрь Тизалуд легко и бістро всасывается, достигая максимальной концентрации в плазме в течение 2–3 часов. Период полувыведения препарата составляет 6–8 часов. Прием пищи и антацидов не изменяет биодоступность Тизалуда. Предполагается гастропротективный эффект препарата за счет угнетения желудочной секреции [2]. Режим дозирования обычно составляет 2–4 мг (1–2 таблетки) три раза в день после еды. Длительность терапии подбирается индивидуально, исходя из динамики клинических проявлений болезни.
С июля по сентябрь 2011 г. на базе городского кабинета медицинской реабилитации больных с поражением периферической нервной системы «УЗ 21-я центральная районная поликлиника» проведено клиническое испытание препарата Тизалуд в комплексном амбулаторном лечении пациентов с болью в нижней части спины.
Цель настоящего исследования – оценка эффективности влияния препарата Тизалуд на основные клинические проявления заболевания, а также его переносимости и безопасности.
Проведено параллельное открытое клиническое испытание в двух группах (основная и контрольная) по 30 больных в каждой с болями в нижней части спины, сопоставимых по возрасту и полу. В основную группу вошли 13 женщин и 17 мужчин, подписавших информированное согласие на добровольное участие в клиническом испытании. Преобладали лица трудоспособного возраста (41±1,8 года). Среди них было 16 пациентов с люмбоишиалгией и 14 больных с моно- и (или) бирадикулярной (L5-Si) дискогенной радикулопатией. Во всех случаях диагнозы соответствовали классификации заболеваний периферической нервной системы (И.П. Антонов,1987). Рандомизация больных по группам проведена методом случайной выборки. Преобладали (70%) пациенты с хроническим течением заболевания. Длительность обострения у них колебалась и составила в среднем 36,7±7,3 дня. Все больные до начала исследования получали НПВП (диклофенак, ибупрофен, артоксан) сроком от 7 до 30 дней.
Дизайн исследования включал традиционный неврологический осмотр, мануальное обследование позвоночника. Выраженность болевого синдрома оценивали с помощью 100 мм визуальной аналоговой шкалы боли (ВАШ): до назначения Тизалуда, через 1 и через 6 часов после однократного первоначального приема препарата в дозе 2 мг, а также через 7 дней лечения. Для субъективной оценки боли применяли опросник МакГилла (The McGill Pain Questionnare, 1975) с помощью которого высчитывали ранговый индекс боли (РИБ) как сумму прилагательных, описывающих сенсорные и эмоциональные ощущения болевого синдрома в баллах. Выраженность мышечнотонического синдрома (МТС) оценивали по разработанной нами 5-балльной шкале. Учитывали степень сколиоза, его распространенность, выраженность повышения мышечного тонуса и формируемый за счет этого феномен миофиксации. Объективизацию напряжения и степень болезненности остистых отростков и паравертебральных точек в поясничном отделе проводили при помощи миотоноальгезиметра (МТА) собственной конструкции и измеряли в кг на см2. Принцип регистрации боли прибором: чем болем выражена боль, тем меньшее усилие нужно приложить для ее появления при надавливании им на локальные точки в поясничном отделе, что фиксируется на табло. Таким образом, отмечалось обратное взаимоотношение между показателем МТА и выраженностью боли. Для исключения иной патологии позвоночника выполняли стандартную рентгенографию поясничного отдела в двух проекциях.
Критерием включения пациентов в исследование было наличие неврологических нарушений, топически связанных с вертеброгенным поражением поясничного отдела позвоночника. Критерии исключения: возраст 70 лет и старше; декомпенсация сопутствующих соматических заболеваний и наличие индивидуальной переносимости препарата. Все пациенты основной группы получали Тизалуд в дозе 6 мг/сут в два приема (2 мг утром и 4 мг вечером) в течение 7 дней. В комплекс лечения включали физиотерапию (магнитотерапию, ультразвук, диадинамические токи). Исключали одновременный прием анальгетиков, антидепрессантов и НПВП. Контрольную группу составили 30 больных с болью в спине, сопоставимых с основной группой по тяж ести клинических проявлений, возрасту, полу, нозологическим формам, которые получали только физиотерапию. Рандомизацию больных по группам провели методом случайной выборки. Клинические проявления заболевания оценивали до и после 7 дней лечения.
Переносимость, побочные реакции, осложнения после приема Тизалуда и его эффективность регистрировали при помощи анкет. Результаты лечения по количественным оценочным шкалам обработаны с помощью программ Excel и Statistica-6.0. Рассчитывали среднее арифметическое и стандартное отклонения. Степень достоверности определяли с помощью «t» критерия Стьюдента. За уровень статистической достоверности принимали результаты при Р<0,05.
До лечения у больных основной и контрольной групп в клинической картине преобладал болевой синдром. Локализация болей обычно включала поясничный отдел позвоночника с иррадиацией в ягодицу и (или) ногу. Боли обычно были асимметричны в равной мере с поражением правой или левой ноги, носили тупой, ноющий характер и всегда усилювались при движениях, ослабевая в покое. Выраженность боли по ВАШ колебалась и составляла 6,5±0,2 см, что соответствовало болевому синдрому выраженной степени.
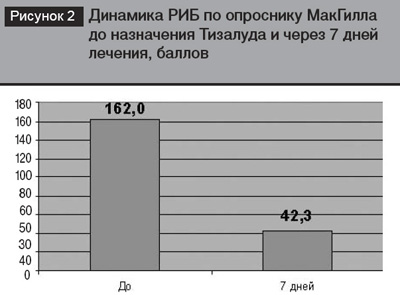
Отмечена эмоциональная окраска боли у обследуемых пациентов с преобладанием таких эпитетов как «изнурительная», «угнетающая», «ноющая». РИБ по опроснику МакГилла составил 162,0±5,4 балла.
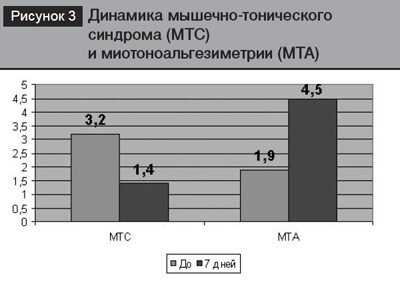
У всех больных отмечено нарушение биомеханики позвоночника с ограничением активных движений в пояснице и напряжением длинных мышц спины. В половине случаев выявили гомо- или гетеролатеральный сколиоз поясничного отдела различной степени выраженности. МТС при объективном осмотре определяли как умеренный, его выраженность была 3,2±0,1 балла. Результаты МТА (1,9±0,1 кг на см2) указывали на мышечное напряжение, выраженную локальную болезненность в проекции остистых отростков и (или) паравертебральных точек пораженных поясничных двигательных сегментов. У пациентов с радикулопатией клиническая картина доповнялась снижением ахиллова рефлекса, слабостью разгибателей большого пальца стопы, гипестезией в зоне соответствующего дерматома, гипотрофией пораженных мышц и симптомами корешкового натяжения (Ласега, Нери, Бехтерева и др.). При рентгенографическом обследовании позвоночника у всех больных выявлены признаки остеохондроза и деформирующего спондилеза поясничного отдела позвоночника, выраженность которых обычно не коррелировала с клинической картиной.
После комплексного лечения с включением Тизалуда более половины пациентов основной группы от метили улучшение в своем состоянии. Уменьшилась интенсивность боли в пояснице и ноге, расширился объем движений в поясничном отделе позвоночника. На рис. 1. представлена динамика боли по ВАШ после первого однократного при ема 2 мг тизалуда. Спустя 60 минут пос ле приема препарата интенсивность боли уменьшилась до 5,0±0,3 балла (отличие статистически недостоверно), спустя 6 часов – до 4,7±0,3 балла Р<0,05), что характерно для умеренной степени боли. Через 7 дней лечения интенсивность болевого синдрома составила 1,4±0,2 бал ла (Р<0,05), что соответствовало легкой степени болевого синдрома. Отмечена позитивная динамика оценки эмоциональной окраски боли. РИБ по опріснику МакГилла значительно уменьшился и составил 42,3±7,8 балла (Р<0,01) (рис. 2). Уменьшилась выраженность МТС до легкой степени 1,4±0,3 балла (Р<0,05), результаты МТА возросли до 4,5±0,2 кг на см2 (Р<0,05), что характеризовало значительно большее усилие, необходимое для появления боли в области поясницы (рис.3).
.jpg)
Результаты терапии 18 (60%) больных оценили как хорошие, 10 (33,3%) пациентов – как удовлетворительные, 2 пациента (6,6%) эффекта лечения не наблюдали. Переносимость препарата у большинства больных была хорошей, однако в 5 случаях (16,6 %) проявились побочные эффекты препарата (у 3 чел. – сухость во рту, сонливость, головокружение; у 2 – кожные аллергические реакции), которые потребовали его отмены.
Пациенты контрольной группы в процессе лечения также наблюдали улучшение состояния, однако его степень и клиническая динамика были менее выражены, чем в основной группе.
Большинство исследователей, занимающихся проблемой дорсопатий, считают, что основной способ лечения этой патологии – медикаментозный. Выбор тактики лечения болей в нижней части спины зависит от этиологии заболевания, возраста пациента, выраженности клинических проявлений и распространенности процесса. Сталкиваясь со стойкой дорсопатией, врачу следует обязательно провести дифференциальную диагностику болей, поскольку кроме дегенеративнодистрофического процесса межпозвонковых дисков причиной боли в спине может быть миофасциальный болевой синдром, остеопороз (особенно у женщин пожилого возраста), спондилолистез и остеоартроз межпозвонковых суставов как проявление полиостеоартроза. Реже причиной дорсопатий являются первичные или метастатические опухоли позвоночника, воспалительные заболевания (остеомиелит, туберкулез, эпидуральные абсцессы), соматоформное болевое расстройство, отраженные боли от внутренних органов и др. [1, 4]. В хронизации боли большое значение отводится дисфункции центральних антиноцицептивных систем, в частности серотонинергических [3].
НПВП обычно оказываются препаратами первой линии терапии дорсопатий. Однако, как показывает клиническая практика, длительный прием неселективных и селективних НПВП не всегда оправдан, так как ведет к серьезным осложнениям со стороны слизистой желудочно-кишечного тракта и кардиотоксичности [2, 5, 6]. Перед врачом часто возникает вопрос, что предпринять, если НПВП не принесли облегчения? Ответом на этот вопрос может быть выбор препарата с миорелаксирующим эффектом как в качестве монотерапии, так и в комбинации с НПВП. Рядом законченных клинических исследований доказан позитивный эффект миорелаксантов для уменьшения мышечно-тонического и болевого синдромов [4, 8, 10]. Однако следует помнить, что рефлекторный мышечный спазм в первые несколько недель обострения дорсопатий является саногенетической реакцией организма и его устранение при помощи миорелаксантов приводит даже к усилению болевого синдрома. Поэтому эту группу препаратов не следует широко назначать в остром периоде заболевания [7]. Однако если дорсопатия принимает затяжное течение, то продолжительный мышечный спазм приобретает негативный характер и способствует хронизации процесса.
В нашем клиническом испытании обследованы и пролечены пациенты с болями в нижней части спины, у которых обострение продолжалось свыше 2 недель и применение наиболее распространенных в настоящее время НПВП было неэффективным. С помощью субъективных (ВАШ, опросник МакГилла) и объективных (МТА, МТС) методик показана преобладающая роль боли и мышечного спазма в клинических проявлениях заболевания. Для лечения нами применялся Тизалуд (как монопрепарат) коротким курсом в дозе 6 мг/сут в течение 7 дней на фоне продолжающейся физиотерапии. Показан позитивный эффект препарата, направленный в первую очередь на устранение регионарного мышечного спазма, что у большинства наблюдавшихся нами больных привело к значительному регрессу болевого синдрома. Однако обращает на себя внимание незначительный эффект Тизалуда у трети пациентов, отсутствие эффекта в 6,6% случаев и побочные эффекты, имевшие место у 16,6% исследуемых, что отмечено и другими исследователями [2, 7, 8]. В связи с этим нам представляется целесообразным сочетанное назначение Тизалуда в меньшей дозе (4 мг/сут) и НПВП. К аналогічному выводу пришли A. Pareek et al., которые в завершенном в 2009 г. мультицентровом исследовании выявили, что сочетание ацеклофенака (НПВП) и тизанидина более эффективно и безопасно для пациентов, чем монотерапия ацеклофенаком [10]. Таким образом, боль в нижней части спины является частым симптомом дорсопатии. Клиническая картина болезни полиморфна. Тизалуд может бать средством выбора в лечении этой патологии. С учетом эффективности препарата целесообразно рекомендовать его к более широкому применению на амбулаторном и стационарном етапах оказания специализированной помощи как в качестве монотерапии так и в комбинации с НПВП.
Литература
- Иванова М.Ф., Евтушенко С.К. // Междунар. неврол. журн. – 2009. – № 3. – С. 124–129.
- Камчатнов П.Р. // Сonsilium medicum. – 2004. – № 2. – С. 12–15.
- Меркулов Ю.А., Онсин А.А., Шаповалов А.В. и др. // Клин. неврология. – 2011. – № 1. – С. 27–30.
- Парфенов В.А. // Рус. мед. журн. – 2009. – № 4. – С. 267–270.
- Садоха К.А. и др. Дорсопатии и их профилактика: учеб.-метод. пособие. – Мн., 2009. – 60 с.
- Шилкина Н.П., Пизова Н.В., Дряженкова И.В. Диагностика и лечение болей в нижней части спины: учеб. метод. пособие. – Ярославль, 2003. – 32 с.
- Сhou R., Huffman L. // Ann. Intern. Med. – 2007. – № 7. – P. 505–514.
- Gorska J. // Ortop. Traumatol. Rehabil. – 2005. – № 3. – P. 306–309.
- Taylor-Stokes G., Lobosco S., Pike J. et al. // Clin. Ther. – 2011 (Epub ahead of print).
- Pareek A., Chandurkar N., Chandanwale A. et al. // Eur. Spine J. – 2009. – № 12. – Р. 1836–1842.






