
 Стаття
Стаття
 20.04.2025
20.04.2025
Перехрест дисфункції жовчного міхура та синдрому подразненого кишечника: клініко-мікробіологічні особливості й терапевтичні можливості
А. Е. дорофєєв 1, С. м. Ткач 2, В. Б. доготар 2, Ю. З. Гуркало 3, Ю. В. Жигаль 1, В. М. Приходько 1; 1) Національний університет охорони здоров’я України імені П. Л. Шупика, Київ; 2) Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, Київ; 3) Українська військово-медична академія.

Мета — проаналізувати клініко-мікробіологічні особливості у хворих із перехрестом дисфункції жовчного міхура (ДЖМ) та синдрому подразненого кишечника (СПК) й провести комплексну оцінку ефективності та безпечності застосування препарату урсодезоксихолевої кислоти («Урсіс®») у цих пацієнтів.
Матеріали та методи. Під нашим спостереженням перебували 115 пацієнтів із перехрестом ДЖМ та СПК віком від 19 до 52 років. Серед них переважали жінки (62,6 %). Усі хворі скаржились на абдомінальний біль, переважно без чіткої локалізації або у правому підребер’ї та по ходу товстого кишечника. Запор діагностовано у 83 (72,2 %) пацієнтів, здуття живота — у 89 (77,4 %). Тому для подальшого дослідження відібрано 62 пацієнтів із перехрестом ДЖМ та СПК, що мали абдомінальний біль, запор і метеоризм. Усі хворі протягом дослідження вели щоденник, в якому реєстрували частоту та характер випорожнення, виразність абдомінального болю, ступінь метеоризму. Усім пацієнтам до та після лікування проводили ультразвукове дослідження черевної порожнини, яке передбачало вивчення скорочувальної функції жовчного міхура, коефіцієнта спорожнення жовчного міхура, товщини та щільності його стінки і щільності жовчі. Проаналізовано зміни основних бактеріальних ентеротипів методом qRT-PCR із використанням праймерів, орієнтованих на 16S рРНК. Вивчали Bacteroidetes, Firmicutes, Actinobacteria, а також вміст бактерій, що продукують бутират (Faecalibacterium prausnitzii та Akkermansia muciniphila) і метаногенів (Methanobrevibacter smithii та Methanosphaera stadmanae).
Результати. До лікування в усіх пацієнтів мали місце абдомінальний біль помірної інтенсивності ((6,9 ± 0,7) бала) переважно без чіткої локалізації, запори з частотою випорожнення (1,4 ± 0,5) разу на тиждень і метеоризм. У пацієнтів із перехрестом ДЖМ та СПК до лікування зареєстровано зміни скорочувальної функції жовчного міхура зі зменшенням коефіцієнта спорожнення, потовщення стінки жовчного міхура та підвищення її щільності та щільності жовчі, а також порушення кишкового мікробіому (збільшення кількості Firmicutes, Actinobacteria і метаногенних архей та зменшення вмісту Bacteroidetes і бактерій, що продукують бутират).
Висновки. Застосування препарату «Урсіс®» у комплексній терапії хворих із перехрестом ДЖМ та СПК є ефективним і безпечним. Призначення препарату сприяло виразнішій позитивній динаміці (зменшенню інтенсивності абдомінального болю, нормалізації частоти випорожнення, зменшенню метеоризму та поліпшенню загального самопочуття), ніж у пацієнтів групи порівняння. Після лікування із застосуванням препарату «Урсіс®» збільшувався коефіцієнт спорожнення жовчного міхура, зменшувалися товщина та щільність його стінки. Використання в комплексній терапії хворих із перехрестом ДЖМ та СПК препарату «Урсіс®» сприяло поліпшенню кишкової флори: збільшенню кількості Bacteroidetes і бактерій, що продукують бутират (Faecalibacterium prausnitzii та Akkermansia muciniphila), і зменшенню вмісту метаногенів (Methanobrevibacter smithii та Methanosphaera stadmanae).
Ключові слова: дисфункція жовчного міхура, синдром подразненого кишечника, клінічні та мікробіологічні особливості, лікування.
Overlap of gallbladder dysfunction and irritable bowel syndrome: clinical and microbiological features and therapeutic possibilities
A. E. Dorofeyev 1, S. M. Tkach 2, v. B. Dogotar 2, Y. Z. hurkalo 3, Y. v. Zhigal 3, v. M. Prikhodko 1
1 Shupyk National Healthcare University of Ukraine, Kyiv
2 Ukrainian Scientific and Practical Center of Endocrine Surgery, Transplantation of Endocrine Organs and Tissues of the Ministry of Health of Ukraine, Kyiv
3 Ukrainian Military Medical Academy
Objective — to analyse the clinical and microbiological features in patients with an overlap between gallbladder dysfunction (GBD) and irritable bowel syndrome (IBS) and a complex assessment of the effectiveness and safety of using ursodeoxycholic acid (Ursis) in these patients.
Materials and metftods. Under our observation were 115 patients with the overlap of GBD and IBS aged from 19 to 52. The majority of them were women (62.6 %). All patients complained of abdominal pain, mostly without clear localization or in the right hypochondrium and along the course of the large intestine. Constipation was diagnosed in 83 (72.2 %) patients, and meteorism in 89 (77.4 %) patients. Therefore, 62 patients with the overlap of GBD and IBS, who had abdominal pain, constipation and meteorism, were selected for further study. During the study, all patients kept a diary in which the frequency and nature of bowel movements, the severity of abdominal pain, and the degree of meteorism were recorded. All patients before and after treatment underwent an ultrasound examination of the abdominal cavity, which included the study of the contractile function of the gallbladder, the emptying coefficient of the gallbladder, the thickness and density of its wall, and the density of bile. Changes in the main bacterial enterotypes were analyzed by qRT-PCR using primers targeting 16S rRNA. We studied Bacteroidetes, Firmicutes, Actinobacteria, as well as the content of butyrate-producing bacteria (Faecalibacterium prausnitzii and Akkermansia muciniphila) and methanogens (Methanobrevibacter smithii and Methanosphaera stadmanae).
Results. Before treatment, all patients had abdominal pain of moderate intensity (6.9 ± 0.7 points), mostly without clear localization, constipation, with a frequency of defecation (1.4 ± 0.5) times a week, and meteorism. Before treatment, patients with an overlap of GBD and IBS had changes in the contractile function of the gallbladder with a decrease in the emptying ratio, a thickening of the gallbladder wall and an increase in its density and bile density, as well as a disturbance of the intestinal microbiome (an increase in the number of Firmicutes, Actinobacteria and methanogenic archaea and a decrease in Bacteroidetes and butyrate-producing bacteria).
Conclusions. The use of Ursis® medication in the complex therapy of patients with a GBD and IBS overlap is effective and safe. The aplication of Ursis® led to a more pronounced positive clinical dynamics (a decrease in the intensity of abdominal pain, normalization of the frequency of bowel movements, a decrease in meteorism and an improvement in general well-being) than in the patients of the comparison group. After treatment with Ursis® the coefficient of emptying of the gallbladder increased, the thickness and density of its wall decreased. The use of the drug Ursis® in the complex therapy of patients with the overlap of GBD and IBS contributed to the improvement of intestinal flora: an increase in the number of Bacteroidetes and butyrate-producing bacteria (Faecalibacterium prausnitzii and Akkermansia muciniphila), and a decrease in the content of methanogens (Methanobrevibacter smithii and Methanosphaera stadmanae).
Keywords: gallbladder dysfunction, irritable bowel syndrome, clinical and microbiological features, treatment.
Захворювання жовчного міхура (ЖМ) у світі та зокрема в Україні за поширеністю поступаються лише атеросклерозу [14]. Щорічно в світі виконують понад 2,5 млн операцій на ЖМ [2, 14]. Останніми роками в Україні збільшилася захворюваність на функціональні ураження біліарної системи [2]. Функціональні захворювання шлунково-кишкового тракту (ШКТ) залишаються великим тягарем для системи охорони здоров’я [6].
Дисфункція жовчного міхура (ДЖМ) найчастіше розвивається в жінок молодого віку, має хронічний перебіг із частими рецидивами, що зумовлює актуальність і медико-соціальну значущість проблеми [4, 6].
Згідно з Римськими критеріями IV ДЖМ і синдром подразненого кишечника (СПК) є окремими функціональними шлунково-кишковими розладами, але в популяційних дослідженнях ці стани часто поєднуються [4, 8]. У світі та зокрема в Україні зареєстровано високу поширеність поєднання ДЖМ і СПК. Епідеміологічні дані свідчать про те, що від 17 до 68 % пацієнтів із будь-яким із цих діагнозів відповідають критеріям іншого діагнозу [8], можливо, існує окрема підгрупа хворих із перехрестом ДЖМ і СПК, яка має генералізоване, а не регіонарне ураження ШКТ зі спільними патофізіологічними механізмами. Синдром подразненого кишечника може бути потенційним чинником ризику розвитку захворювань біліарної системи, зокрема ДЖМ. У 48,9 % пацієнтів зі СПК виявляють моторні порушення біліарного тракту, які не можна пояснити органічною патологією. Хворим на СПК частіше проводять холецистектомію [3], а ДЖМ може впливати на розвиток і перебіг СПК. Це пов’язано з тим, що несвоєчасне та недостатнє надходження жовчі в просвіт кишечника може модифікувати стан кишкового мікробіому. Кількісні та якісні зміни жовчних кислот впливають на проникність кишкового бар’єра та запалення слизової оболонки кишечника. Жовчні кислоти беруть участь у регуляції кишкової перистальтики [12]. Тому одним із важливих спільних патогенетичних механізмів розвитку ДЖМ і СПК є зміни кишкової мікробіоти, які, окрім клінічної картини, можуть бути маркером оцінки тяжкості перебігу захворювання й ефективності лікування.
У хворих на СПК змінюється кількість основних представників кишкового мікробіому (Bacte‑ roidetes, Firmicutes, Actinobacteria) [11]. Останнім часом важливу роль у розвитку СПК відводять модифікації кишкової мікробіоти з порушенням метаболічної активності товстокишкової флори. У хворих на СПК не лише змінюються ентеротипи кишкової мікробіоти, що порушує співвідношення анаеробів і аеробів, а й зменшується кількість регуляторних бактерій, таких як Faecalibacterium prausnitzii та Akkermansia muciniphila [13]. Це призводить до підвищення проникності слизового бар’єра кишечника, формування вісцеральної гіперчутливості й розвитку клінічної картини захворювання. Крім того, важливою компонентою здорового мікробіому є кількість і активність метаногенної флори, яка може відігравати значну роль у патогенезі ДЖМ зі СПК. Модифікація співвідношення бродильних і гнилісних процесів у кишечнику зі зростанням частки анаеробів, що продукують метан, може призвести до зменшення декон’югації жовчних кислот і підвищення газоутворення за рахунок метану. Останній сповільнює транзит, пригнічує перистальтику та підвищує тонус стінки кишечника [10].
Скаргою, що переважає в пацієнтів із перехрестом ДЖМ та СПК, є абдомінальний біль (АБ) із не завжди типовою локалізацією різної інтенсивності, який може мати зв’язок із прийомом їжі та дефекацією, що утруднює встановлення правильного діагнозу. Рання діагностика й адекватна терапія перехресту ДЖМ із СПК має важливе клінічне значення, оскільки ризик трансформації такої комбінації функціональних уражень ШКТ в органічну патологію (хронічний холецистит, жовчнокам’яна хвороба, біліарний панкреатит тощо) дуже високий [2].
Нині немає чіткого розуміння щодо можливості застосування урсодезоксихолевої кислоти (УДХК) у хворих із перехрестом ДЖМ і СПК. Патогенетично зумовлене підґрунтя ефективного використання УДХК при перехресті ДЖМ та СПК сприятиме поліпшенню лікування цієї патології.
Мета роботи — проаналізувати клініко-мікробіологічні особливості у хворих із перехрестом дисфункції жовчного міхура та синдрому подразненого кишечника й провести комплексну оцінку ефективності та безпечності застосування препарату урсодезоксихолевої кислоти в цих пацієнтів.
Матеріали та методи
Проведено проспективне рандомізоване сліпе мультицентрове порівняльне дослідження в паралельних групах.
Під нашим спостереженням перебували 115 пацієнтів із перехрестом ДЖМ та СПК віком від 19 до 52 років без супутньої органічної патології, які впродовж останнього року не мали гострих кишкових інфекцій, останніх 6 міс не приймали антибіотиків, не мали онкологічної патології та психічних розладів. Серед пацієнтів переважали жінки (62,6 %).
Діагноз ДЖМ і СПК установлювали згідно з Римськими критеріями IV перегляду. Випорожнення класифікували відповідно до Брістольської шкали калу [6]. Усі хворі скаржилися на АБ, переважно без чіткої локалізації або в правому підребер’ї та по ходу товстого кишечника. Запор діагностовано в 83 (72,2 %) пацієнтів, здуття живота — у 89 (77,4 %). Тому для подальшого дослідження відібрано 62 пацієнтів із перехрестом ДЖМ і СПК, що мали АБ, запор та метеоризм. Серед них переважали жінки (61,3 %).
Усі хворі протягом дослідження вели щоденник, в якому реєстрували частоту та характер випорожнень, виразність абдомінального болю (АБ), ступінь метеоризму (від 0 до 3, де 0 — відсутність здуття, 3 — максимальний метеоризм) і загальне самопочуття. Пацієнти оцінювали АБ за візуальною аналоговою шкалою (ВАШ, де 0 — відсутність болю, 10 — максимально інтенсивний АБ) до лікування, на 14-й і 28-й день терапії та після закінчення курсу прийому препаратів.
Усім пацієнтам до та після лікування проводили ультразвукове дослідження черевної порожнини, яке, окрім сонографії печінки, жовчних проток, ЖМ та підшлункової залози, передбачало вивчення скорочувальної функції ЖМ (СФЖМ). Для цього проводили динамічну сонографію ЖМ із пробним сніданком (сорбіт 20 г на 100 мл теплої води). Вимірювали об’єм ЖМ (V0) до сніданку та через 5, 15, 30, 45 і 60 хв після прийому розчину сорбіту. Об’єм ЖМ розраховували за формулою:
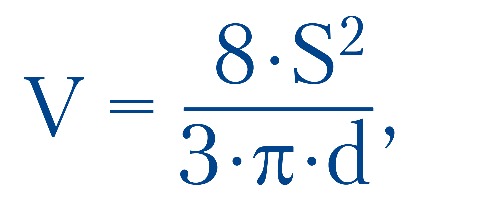
де S — площа зображення ЖМ, см2;
d — довжина ЖМ, см; p = 3,14.
Коефіцієнт спорожнення (КС) ЖМ після жовчогінного сніданку розраховували за формулою:
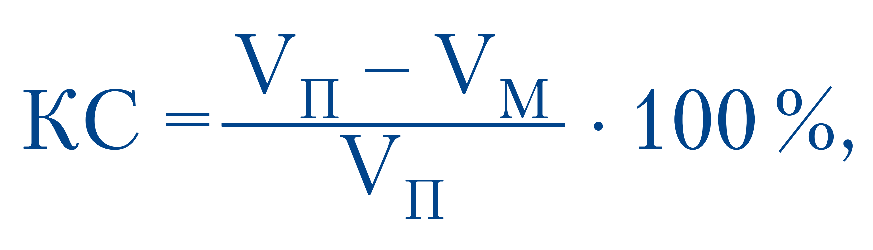
де Vп — початковий об’єм ЖМ;
Vм — мінімальний об’єм ЖМ наприкінці періоду спорожнення.
Показники S і d розраховував автоматично процесор, вмонтований в ехосканер, при цифровій обробці зображення ЖМ.
Діагноз ДЖМ установлювали клінічно з урахуванням КС ЖМ, за величиною якого можна опосередковано оцінити моторику ЖМ. Єдиної думки щодо оцінки ехографічних показників СФЖМ немає, але досвід більшості дослідників дає змогу оцінити значення КС 50—75 % як нормальні. У нашому дослідженні СФЖМ оцінювали як знижену (гіпокінезія) при КС < 50 % від первинного об’єму ЖМ і як підвищену (гіперкінезія) при КС > 75 % від первинного об’єму ЖМ.
У більшості хворих із ДЖМ під час сонографії виявлено потовщення стінок ЖМ і біліарний сладж без додаткових клінічних та лабораторних ознак запалення. Наявність біліарного сладжу призводить до трансформації ДЖМ у жовчнокам’яну хворобу з потенційним розвитком ускладнень і необхідністю хірургічного втручання (рис. 1).
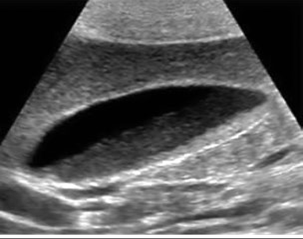 Рис. 1. Формування сладжу у хворої з дисфункцією жовчного
Рис. 1. Формування сладжу у хворої з дисфункцією жовчного
міхура та синдромом подразненого кишечника
Для виявлення сладжу у хворих із перехрестом ДЖМ та СПК вивчали стан стінки ЖМ у чотирьох стандартних зонах: 1-ша зона — печінкова стінка ЖМ у ділянці дна, 2-га зона — печінкова стінка ЖМ у ділянці шийки, 3-тя зона — вільна стінка ЖМ у ділянці дна, 4-та зона — вільна стінка ЖМ у ділянці шийки.
Крім того, вивчали щільність стінки ЖМ і жовчі. Коефіцієнт щільності визначали шляхом поділу пікселів по шкалі сірого кольору від 0 до 64. Розраховували два параметри: М — кількість пікселів, що частіше трапляються, Т — загальну кількість пікселів. Коефіцієнт щільності розраховували за формулою: КЩ = М : Т · 100 %.
Зміни кишкового мікробіому можна роз-
глядати як один із важливих патогенетичних механізмів розвитку функціональних уражень ШКТ, особливо з розвитком перехресту та коморбідності захворювань [6, 13]. Тому у хворих із ДЖМ і СПК до та після терапії вивчали особливості мікробіоти кишечника. Проаналізовано зміни основних бактеріальних ентеротипів методом qRT-PCR з використанням праймерів, орієнтованих на 16S рРНК (табл. 1).
Таблиця 1. Використані бактеріальні праймери
| Флора | Структура праймерів | |
| Bacteroidetes | Прямий | 798ebFAAACTCAAАКGAАTTGACGG |
| Зворотний | cfb967RGGTAAGGTTCCTCGCGTAT | |
| Firmicutes | Прямий | 928F-FirmTGAAACTYAAAGGAATTGACG |
| Зворотний | 1040FirmRACCATGCACCACCTGTC | |
| Actinobacteria | Прямий | Act920F3 TACGGCCGCAAGGCTA |
| Зворотний | Act1200RTCRTCCCCACCTTCCTCCG | |
| Akkermansia muciniphila | Прямий | CAGCACGTGAAGGTGGGGAC |
| Зворотний | CCTTGCGGTTGGCTTCAGAT | |
| Faecalibacterium prausnitzii | Прямий | GGAGGAAGAAGGTCTTCGG |
| Зворотний | AATTCCGCCTACCTCTGCACT | |
| Methanobrevibacter smithii | Прямий | 5′-ATGCACCTCCTCTCAGCTAGTC-3 |
| Зворотний | 5′-AGAGGTACTCCCAGGGTAGAGG-3 | |
| Methanosphaera stadmanae | Прямий | 5′-AGGAGCGACAGCAGAATGAT-3′ |
| Зворотний | 5′-CAGGACGCTTCACAGTACGA-3′ | |
| Universal | Прямий | 926FAAACTCAAAKGAATTGACGG |
| Зворотний | 1062RCTCACRRCACGAGCTGAC | |
Вивчали Bacteroidetes, Firmicutes, Actinobacteria, а також рівень регуляторних бактерій, що продукують бутират, — Faecalibacterium prausnitzii та Akkerman‑ sia muciniphila. Археї Methanobrevibacter smithii та Methanosphaera stadmanae можна розглядати як потенційні мікробіологічні маркери у хворих, що страждають на запор і метеоризм. Крім того, ці представники кишкового мікробіому можуть впливати на метаболізм жовчних кислот і призвести до розвитку біліарної дисфункції [5, 13]. Тому в обстежених пацієнтів вивчали рівень флори, що продукує метан, — Methanobrevibacter smithii та Methanosphaera stadmanae.
Також вивчено кишкову мікробіоту 72 практично здорових аналогічного віку, які утворили контрольну групу.
Статистичний аналіз виконано за допомогою програмного забезпечення Statistica v12.6. Опис даних проведено з використанням середньої арифметичної величини (М) та її стандартної похибки (m) при нормальному розподілі та медіани (Me) і 25-го та 75-го квартилей (Q25, Q75) для розподілу, що відрізнявся від нормального. Нормальність розподілу перевіряли за критерієм асиметрії та ексцесу. Використовували методи параметричної статистики (t-критерій Стьюдента) і непараметричні (U-критерій Манна — Уїтні, c2). Статистично значущою вважали різницю при p < 0,05.
Усім пацієнтам до початку дослідження роз’яснено суть дослідження та процес його проведення. У кожного хворого отримано підписану інформовану згоду на участь у дослідженні. Дослідження проведене з дотриманням вимог Гельсінської декларації та законодавства України. Участь у ньому була добровільною та анонімною. Усі хворі ознайомлені з інструкцією до препарату, попереджені про можливі побічні ефекти та індивідуальну непереносність. Відмовитися від участі в дослідженні можна було на будь-якому етапі з подальшим отриманням необхідної медичної допомоги.
Доведено ефективність препаратів УДХК при багатьох захворюваннях печінки та біліарної системи, зокрема тих, що перебігають з явищами холестазу [9]. Завдяки холеретичній, літолітичній та імуномодулювальній дії УДХК можна застосовувати в лікуванні не лише органічних, а й функціональних захворювань. Жовчні кислоти беруть активну участь у регуляції кишкового мікробіому, забезпечуючи його стабільність [12]. При порушенні гомеостазу або модифікації метаболізму жовчних кислот розвиваються порушення кишкової мікробіоти, що призводить до зміни слизового бар’єра кишечника, формуванню вісцеральної гіперчутливості та мікрозапалення в слизовій оболонці товстої кишки [15]. Тому використання препаратів УДХК у комплексному лікуванні хворих із перехрестом ДЖМ та СПК є перспективним напрямом патогенетичної терапії цих захворювань. В Україні виробником УДХК, що має сертифікацію належної виробничої практики (GMP), є АТ «Київський вітамінний завод» (КВЗ), який виробляє препарат «Урсіс®». Дослідження виявило біоеквівалентність і порівнянну переносність препарату «Урсіс®» референтному засобу.
Після рандомізації 30 пацієнтів із перехрестом ДЖМ і СПК отримували препарат «Урсіс®» у дозі 750 мг/добу та спазмолітик мебеверин («Аспазмін», КВЗ) за потреби за наявності АБ, при зниженні інтенсивності або відсутності болю на тлі лікування дозу спазмолітика зменшували або відміняли препарат (основна група). Групу порівняння утворили 32 пацієнти, які приймали жовчогінні препарати, що не містять УДХК, і мебеверин (за потреби).
Усю інформацію щодо прийому спазмолітиків хворі фіксували в щоденнику, який перевіряли на 14, 28 та 42-й день терапії та під час візиту в період спостереження. Загалом дослідження тривало 14 тиж, з яких у перших 3 тиж проводили аналіз історії хвороби, оцінювали відповідність критеріям залучення/вилучення, обговорювали з пацієнтом участь у дослідженні та отримували інформовану згоду. На 4-му тижні пацієнтів рандомізували на дві групи. Лікування тривало 42 дні. Через 2 тиж після закінчення терапії — контрольний візит.
Результати та обговорення
До лікування в усіх пацієнтів мав місце АБ помірної інтенсивності (6,9 ± 0,7 за ВАШ) переважно без чіткої локалізації (34 (54,8 %) хворих), запор із частотою випорожнення (1,4 ± 0,5) разу на тиждень і метеоризм (58 (93,5 %) пацієнтів). На тлі лікування в усіх пацієнтів зареєстрували позитивну клінічну динаміку, яка дещо відрізнялась у групах хворих (рис. 2).
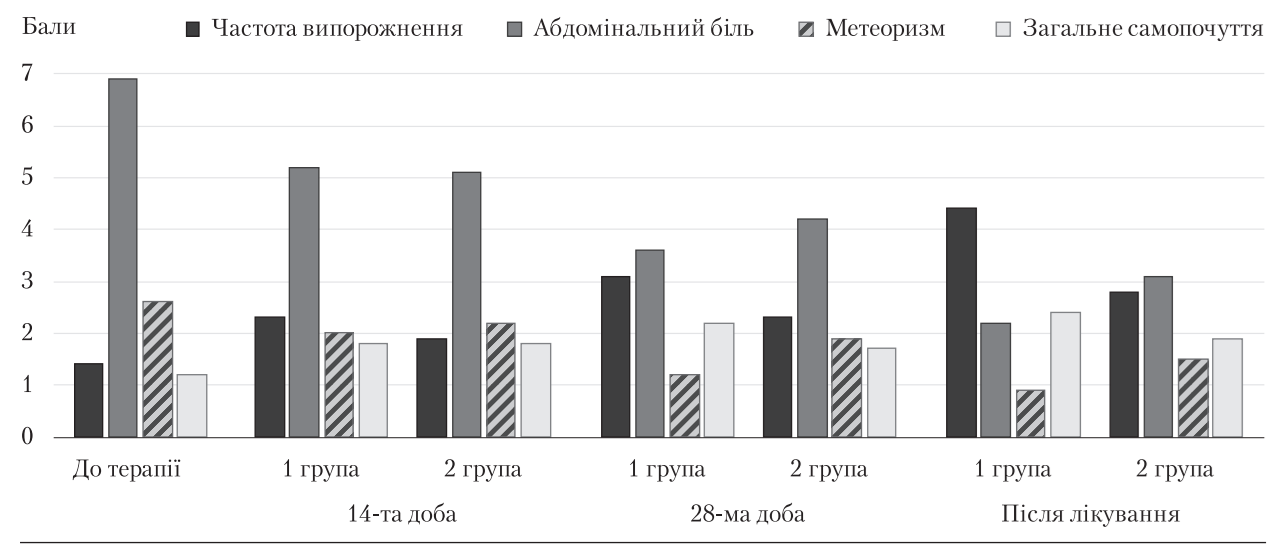
Рис. 2. Динаміка абдомінального болю, частоти випорожнення, метеоризму та загального самопочуття у хворих до та після терапії
Зниження інтенсивності АБ у пацієнтів, що приймали «Урсіс®», було більшим, ніж у групі порівняння. Хоча через 2 тиж терапії зменшення АБ в обох групах не відрізнялось, на 28-й день лікування інтенсивність АБ у хворих, що приймали «Урсіс®», знижувалась майже вдвічі ((3,6 ± 0,4) бала) порівняно з показником до лікування (р < 0,05). Починаючи з (18,3 ± 3,1) дня терапії, 20 (66,7 %) пацієнтів цієї групи не потребували призначення спазмолітиків, тоді як 17 (53,1 %) хворих групи порівняння приймали спазмолітики до завершення дослідження (р < 0,05).
У пацієнтів основної групи вже на 14-й день лікування статистично значущо збільшувалася частота випорожнень, а через 4 тиж терапії цей показник нормалізувався ((3,1 ± 0,4) разу на тиждень), тоді як у пацієнтів групи порівняння в ці терміни частота випорожнення була низькою, хоча і мала тенденцію до збільшення, але після закінчення терапії не досягала норми ((2,8 ± 0,4) разу на тиждень, р < 0,05).
Збільшення частоти випорожнення корелювало зі зниженням інтенсивності метеоризму, яка на 28-й день терапії була статистично значущо нижчою у пацієнтів, що приймали «Урсіс®» (р < 0,05). Після завершення курсу лікування інтенсивність метеоризму в основній групі хворих була в 1,7 разу нижчою, ніж у групі порівняння ((0,9 ± 0,2) та (1,5 ± 0,2) бала відповідно, р < 0,05). Позитивна клінічна динаміка сприяла поліпшенню загального самопочуття, яке підвищувалось більшою мірою в пацієнтів, які приймали «Урсіс®».
Таким чином, застосування препаратів УДХК («Урсіс®») у комплексній терапії хворих із перехрестом ДЖМ і СПК сприяло виразнішій позитивній динаміці (зменшенню інтенсивності АБ, нормалізації частоти випорожнення, зменшенню метеоризму та поліпшенню загального самопочуття), ніж у пацієнтів групи порівняння.
За даними динамічної сонографії біліарного тракту із пробним сніданком до лікування у 48 (77,4 %) пацієнтів із перехрестом ДЖМ та СПК зареєстровано гіпомоторну дисфункцію ЖМ зі зниженням СФЖМ, у 14 (22,6 %) — гіпермоторну ДЖМ із підвищенням СФЖМ. Для детальнішої оцінки моторики ЖМ проаналізовано динаміку КС ЖМ.
До лікування КС ЖМ у хворих із перехрестом ДЖМ та СПК був зниженим ((38,4 ± 3,9) %). Після лікування він збільшився в обох групах, але в пацієнтів, які приймали «Урсіс®», цей показник був статистично значущо вищим ((64,8 ± 5,2) і (53,9 ± 5,3) % відповідно, р < 0,05) (табл. 2).
Таблиця 2. Щільність стінки ЖМ і жовчі та коефіцієнт спорожнення жовчного міхура до та після лікування
|
Показник |
До терапії |
Після терапії | |
| Основна група | Група порівняння | ||
| Щільність стінки, од. сірої шкали | 31,42 ± 3,03* | 20,53 ± 1,92* | 27,38 ± 2,72# |
| Щільність жовчі, од. сірої шкали | 8,62 ± 1,13* | 2,68 ± 0,26* | 5,47 ± 0,53*# |
| КС ЖМ, % | 38,4 ± 3,9 | 64,8 ± 5,2* | 53,9 ± 5,3*# |
Примітка. * Різниця щодо показників до лікування статистично значуща (p < 0,05).
# Різниця щодо показників основної групи статистично значуща (p < 0,05).
При вивченні товщини стінки ЖМ у 4 зонах виявлено, що у хворих із перехрестом ДЖМ та СПК до лікування цей показник в усіх зонах мав тенденцію до збільшення, хоча статистично значущо не відрізнявся від норми (< 0,2 см) (табл. 3).
Таблиця 3. Товщина стінки жовчного міхура у пацієнтів із перехрестом дЖМ та СПк до та після терапії, см
| Зона | До терапії | Після терапії | |
| Основна група | Група порівняння | ||
| 1 | 0,32 ± 0,03 | 0,17 ± 0,01* | 0,32 ± 0,02# |
| 2 | 0,37 ± 0,04 | 0,22 ± 0,01* | 0,35 ± 0,02# |
| 3 | 0,36 ± 0,03 | 0,28 ± 0,02 | 0,37 ± 0,03 |
| 4 | 0,35 ± 0,02 | 0,27 ± 0,02 | 0,36 ± 0,02 |
Примітка. * Різниця щодо показників до лікування статистично значуща (p < 0,05).
# Різниця щодо показників основної групи статистично значуща (p < 0,05).
Після лікування у пацієнтів, які приймали «Урсіс®», зареєстровано нормалізацію товщини стінки ЖМ в усіх зонах, але статистично значуще зниження — у 1-й та 2-й зонах (р < 0,05), завдяки поліпшенню реології жовчі, збільшенню її текучості та зменшенню пристінкових, зокрема холестеринових, відкладень, з яких потім може формуватися сладж. Ці зміни частіше починаються в печінкових зонах ЖМ, тому, можливо, застосування УДХК («Урсіс®») сприяло позитивній динаміці. У пацієнтів групи порівняння після терапії товщина стінки ЖМ практично не змінювалась і залишалась більшою, ніж у хворих основної групи (р < 0,05).
При аналізі щільності стінки ЖМ і жовчі з’ясовано, що в пацієнтів із перехрестом ДЖМ та СПК до терапії спостерігалось збільшення щільності стінки ЖМ і жовчі (див. табл. 2).
Після комплексної терапії із застосуванням препарату «Урсіс®» щільність стінки ЖМ статистично значущо зменшувалася ((20,53 ± 1,92) од. сірої шкали, р < 0,05), тоді як у пацієнтів групи порівняння виявлено лише тенденцію до зменшення щільності стінки ЖМ, яка залишалась статистично значущо щільнішою, ніж у хворих основної групи (р < 0,05). Після терапії в обох групах хворих зареєстровано статистично значуще зниження щільності жовчі порівняно з показниками до лікування, але у хворих основної групи зміни були виразнішими ((2,68 ± 0,26) та (5,47 ± 0,53) од. сірої шкали відповідно, р < 0,05).
Таким чином, у пацієнтів із перехрестом ДЖМ та СПК до терапії спостерігаються зміни СФЖМ зі зменшенням КС, потовщення стінки ЖМ, підвищення її щільності та щільності жовчі. Після лікування із застосуванням препарату «Урсіс®» збільшується КС ЖМ, зменшується товщина стінки, особливо в печінкових зонах дна і шийки ЖМ та знижується щільність стінки ЖМ і жовчі.
Кишковий мікробіом у пацієнтів із перехрестом ДЖМ та СПК до лікування був змінений. Вміст основних представників кишкового мікробіому — Bacteroidetes, Firmicutes, Actinobac‑ teria характеризувався збільшенням частки Firmicutes ((43,6 ± 4,1) %, норма — (35,0 ± 3,4) %, р < 0,05) і Actinobacteria ((22,0 ± 1,9) %, норма — (17,0 ± 2,0) %, р < 0,05) та зменшенням частки Bacteroidetes ((29,2 ± 3,1) %, норма — (42,5 ± 4,5 %, р < 0,05) (рис. 3).
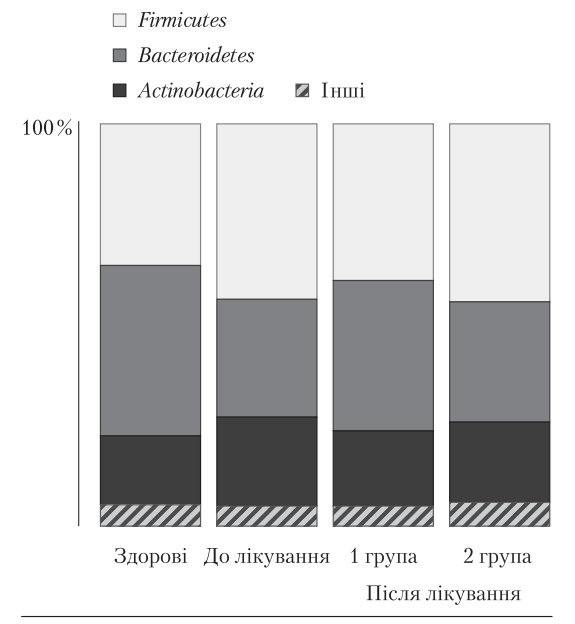
Рис. 3. Рівень bacteroidetes, Firmicutes, actinobacteria у здорових осіб та
хворих із перехрестом дЖМ і СПк до та після терапії
Після лікування в пацієнтів, які приймали «Урсіс®», виявлено тенденцію до нормалізації кишкового мікробіому: зменшення частки Fir‑ micutes і Actinobacteria та статистично значуще збільшення частки Bacteroidetes до (37,2 ± 3,9) % (р < 0,05). У пацієнтів групи порівняння такі зміни не відбувалися, а досліджувані показники не відрізнялися від вихідних.
Одними з основних регуляторних штамів облігатної флори є представники бактерій, що продукують бутират, — Faecalibacterium prausnitzii та Akkermansia muciniphila, кількість яких зумовлює стабільність здорового кишкового мікробіому [7], тому рівень цих бактерій може бути мікробіологічним маркером інтенсивності дисбіозу, зокрема у хворих із коморбідною функціональною патологією ДЖМ зі СПК. З огляду на те, що в усіх пацієнтів, залучених у дослідження, виявлено запори, що патогенетично можуть бути пов’язані з гіперпродукцією метану та розвитком метаногенної флори (Methanobrevibacter smithii та Methanosphaera stadmanae), рівень цих архей у кишковому мікробіомі може відображувати потенційний ризик порушення кишкової моторики. У хворих із перехрестом ДЖМ та СПК до терапії вміст бактерій, що продукують бутират і метан, відрізнявся від нормального (рис. 4).
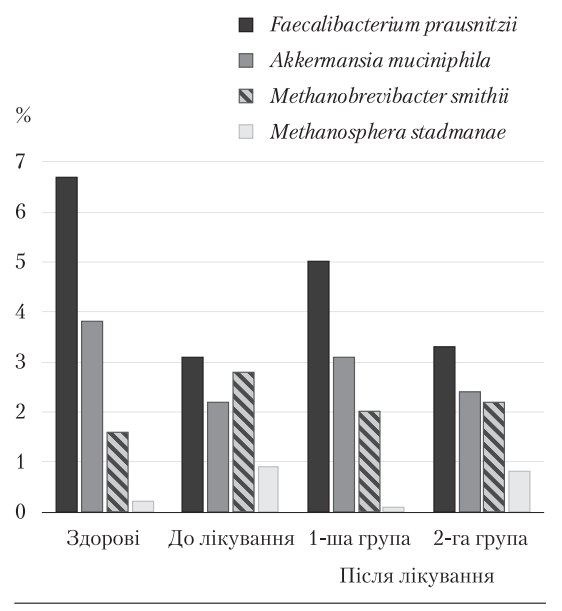
Рис. 4. Вміст бактерій, що продукують бутират і метан, у здорових осіб та
хворих із перехрестом дЖМ і СПк до та після терапії
Частка Faecalibacterium prausnitzii та Akkermansia muciniphila у пацієнтів із коморбідною функціональною патологією знижувалася ((3,1 ± 0,3) %, норма — (6,7 ± 0,7) %, та (2,2 ± 0,3) %, норма — (3,8 ± 0,4) % відповідно, р < 0,05). Водночас кількість метаногенних архей у кишковому мікробіомі пацієнтів із перехрестом ДЖМ та СПК до лікування зростала (Methanobrevibacter smithii — (2,8 ± 0,3) %, норма — (1,6 ± 0,2) %, р < 0,05, Methanosphaera stadmanae — (0,9 ± 0,1) %, р < 0,05). Ці зміни корелювали з інтенсивністю клінічних виявів та сонографічними порушеннями моторики ЖМ. Зменшення кількості бактерій, що продукують бутират, — з інтенсивністю АБ (r = 0,52), зниженням СФЖМ (r = 0,59) та підвищенням щільності жовчі (r = 0,64), збільшення вмісту метаногенів — зі зменшенням кількості випорожнень (r = 0,67) та КС ЖМ (r = 0,65). Це свідчить про важливу патогенетичну роль змін кишкової мікробіоти в розвитку, прогресуванні та ступені тяжкості перебігу коморбідної функціональної патології ДЖМ і СПК.
Після лікування у хворих основної групи виявлено тенденцію до нормалізації регуляторної та метаногенної флори. Частка Faecalibacterium prausnitzii збільшувалася до (5,0 ± 0,5) % (р < 0,05), частка Akkermansia muciniphila наближалася до нормальних показників ((3,1 ± 0,3) %, р < 0,05). На тлі збільшення кількості бактерій, що продукують бутират, у цих пацієнтів зареєстровано зниження частки Methanobrevibacter smithii до (2,0 ± 0,2) % (р < 0,05), тоді як частка Methanosphaera stadma‑ nae нормалізувалась (р < 0,01). У пацієнтів групи порівняння статистично значущих змін бактерій, що продукують бутират, і метаногенної флори після лікування не відзначено.
Таким чином, у пацієнтів із перехрестом ДЖМ та СПК мають місце порушення кишкового мікробіому (збільшення кількості Firmicutes і Actinobacteria та зменшення кількості Bacte‑ roidetes). Крім того, у цих пацієнтів спостерігається зниження вмісту бактерій, що продукують бутират (Faecalibacterium prausnitzii та Akkerman‑ sia muciniphila) і збільшення кількості метаногенних архей (Methanobrevibacter smithii та Meth‑ anosphaera stadmanae) у кишковому мікробіомі. Використання в комплексній терапії хворих із перехрестом ДЖМ та СПК препарату «Урсіс®» сприяло збільшенню кількості Bacteroidetes і бактерій, що продукують бутират, та зменшенню вмісту метаногенів.
При використанні препарату «Урсіс®» у комплексній терапії хворих із перехрестом ДЖМ та СПК побічних ефектів не зареєстровано. Препарат добре переносився всіма хворими.
Висновки
Застосування препарату «Урсіс®» у комплексній терапії хворих із перехрестом ДЖМ та СПК є ефективним і безпечним.
Призначення препарату сприяло виразнішій позитивній динаміці (зменшенню інтенсивності АБ, нормалізації частоти випорожнення, зменшенню метеоризму та поліпшенню загального самопочуття), ніж у пацієнтів групи порівняння.
Після лікування із застосуванням препарату «Урсіс®» збільшувався КС ЖМ, зменшувалася товщина його стінки, особливо в печінкових зонах дна і шийки ЖМ, та знижувалася щільність стінки ЖМ і жовчі.
Використання в комплексній терапії хворих із перехрестом ДЖМ та СПК препарату «Урсіс®» сприяло поліпшенню кишкової флори: збільшенню кількості Bacteroidetes і бактерій, що продукують бутират (Faecalibacterium praus‑ nitzii та Akkermansia muciniphila), і зменшенню вмісту метаногенів (Methanobrevibacter smithii та Methanosphaera stadmanae).
Список літератури
-
- Дорофєєв АЕ, Ткач СМ, Жигаль ЮВ та ін. Оцінка ефективності застосування інуліну в терапії пацієнтів із синдромом подразненого кишечника із запором. Сучас на гастроентерологія. 2023;2:51-8. doi: https://doi. org/10.30978/MG-2023-2-51.
- Павлович ЮВ, Крижевський ВВ, Біляєва ОО. Оптимізація діагностики і лікування гострого холециститу та сучасні заходи профілактики інтраопераційних та післяопераційних ускладнень. Укр. мед. часопис. 2022;I-IV(1-2). doi: 32471/umj.1680-3051.147.228624.
- Afghani E, Lo SK, Covington PS, Cash BD, Pandol Sphincter of Oddi Function and Risk Factors for Dysfunction. Front Nutr. 2017 Jan 30;4:1. doi: 10.3389/fnut.2017.00001. PMID: 28194398; PMCID: PMC5276812.
- Bouchoucha M, Deutsch D, Uong P, Mary F, Sabate JM, Benamouzig R. Characteristics of patients with overlap functional gastrointestinal disorders. J Gastroenterol Hepatol. 2021 Aug;36(8):2171-9. doi: 1111/jgh.15438.
- Dridi B, Henry M, El Khéchine A, Raoult D, Drancourt
High prevalence of Methanobrevibacter smithii and Methanosphaera stadtmanae detected in the human gut using an improved DNA detection protocol. PLoS One. 2009 Sep 17;4(9):e7063. doi: 10.1371/journal.pone.0007063. PMID: 19759898; PMCID: PMC2738942 - Drossman DA, Hasler WL Rome IV-Functional GI Disorders: Disorders of Gut-Brain Interaction. 2016;150(6):1257-61. doi: 10.1053/j.gastro.2016.03.035.
- Effendi RMRA, Anshory M, Kalim H, Dwiyana RF, Suwarsa O, Pardo LM, Nijsten TEC, Thio HB. Akkermansia muciniphila and Faecalibacterium prausnitzii in Immune-Related Diseases. Microorganisms. 2022 Nov 30;10(12):2382. doi: 3390/microorganisms10122382. PMID: 36557635; PMCID: PMC9782003.
- Guliter S, Yilmaz S, Yakaryilmaz F, Keles H. Evaluation of gallbladder motility in patients with irritable bowel syn Swiss Med Wkly. 2005 Jul 9;135(27-28):407-11. doi: 10.4414/smw.2005.11103. PMID: 16220411.
- Hong S, Lee Y, Shin H, Kim T, Jung E, Lee Nanoassemblies of disulfide-bridged bile acid dimers as therapeutics agents for hepatic ischemia/reperfusion injury. ACS Appl Bio Mater. 2021 Apr 19;4(4):3145-54. doi: 10.1021/acsabm.0c01554.
- Kim G, Deepinder F, Morales W, et al. Methanobrevibacter smithii is the predominant methanogen in patients with constipation-predominant IBS and methane on breath. Dig Dis Sci. 2012 Dec;57(12):3213-8. doi: 10.1007/s10620-0122197-1. Epub 2012 May PMID: 22573345.
- Nishijima S, Suda W, Oshima K, et The gut microbiome of healthy Japanese and its microbial and functional uniqueness. DNA Res. 2016 Apr;23(2):125-33. doi: 10.1093/dnares/ dsw002. Epub 2016 Mar 6.
- Phelan JP, Reen FJ, Caparros-Martin JA, O’Connor R, O’Gara Rethinking the bile acid/gut microbiome axis in cancer. Oncotarget. 2017 Dec 1;8(70):115736-47. doi: 10.18632/ oncotarget.22803. PMID: 29383197; PMCID: PMC5777809.
- Takakura W, Pimentel M. Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome — An Update. Front 2020 Jul 10;11:664. doi: 10.3389/fpsyt.2020.00664. PMID: 32754068; PMCID: PMC7366247.
- Unalp-Arida A, Ruhl Increasing gallstone disease prevalence and associations with gallbladder and biliary tract mortality in the US. Hepatology. 2023 Jun 1;77(6):1882-95. doi: 10.1097/HEP.0000000000000264.
- Wahlström A, Sayin SI, Marschall HU, Bäckhed Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism. Cell Metab. 2016 Jul 12;24(1):4150. doi: 10.1016/j.cmet.2016.05.005. Epub 2016 Jun 16. PMID: 27320064.






