
 Стаття
Стаття
 18.04.2025
18.04.2025
ОСОБЛИВА РОЛЬ ЦІЛОСТАЗОЛУ В ЛІКУВАННІ ПАЦІЄНТІВ З ВИЯВАМИ ПЕРЕМІЖНОЇ КУЛЬГАВОСТІ ЗГІДНО З РЕКОМЕНДАЦІЯМИ ДОКАЗОВОЇ МЕДИЦИНИ
І. М. Гудз Івано-Франківський національний медичний університет

Проаналізовано дані доказової медицини щодо консервативного лікування пацієнтів з периферійними оклюзійними захворюваннями в стадії переміжної кульгавості. Наведено дані досліджень, які патогенетично обґрунтовують доцільність призначення цілостазолу для лікування цієї категорії пацієнтів. Результати багатоцентрових рандомізованих плацебоконтрольованих досліджень свідчать про клінічні та економічні переваги цілостазолу над пентоксифіліном та іншими вазоактивними препаратами при лікуванні пацієнтів з виявами переміжної кульгавості. Існує велика доказова база щодо безпечності тривалого призначення цілостазолу.
Ключові слова: цілостазол, переміжна кульгавість, лікування, доказова медицина.
ОСОБЕННАЯ РОЛЬ ЦИЛОСТАЗОЛА В ЛЕЧЕНИИ ПАЦИЕНТОВ С ПРОЯВЛЕНИЯМИ ПЕРЕМЕЖАЮЩЕЙСЯ ХРОМОТЫ СОГЛАСНО РЕКОМЕНДАЦИЯМ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ
И. М. Гудз
Ивано-Франковский национальный медицинский университет
Проанализированы данные доказательной медицины относительно консервативного лечения пациентов с периферическими окклюзионными заболеваниями в стадии перемежающейся хромоты. Представлены данные исследований, которые патогенетически обосновывают целесообразность назначения цилостазола для лечения данной категории больных. Результаты многоцентровых рандомизированных плацебоконтролированных исследований указывают на клинические и экономические преимущества цилостазола перед пентоксифиллином и другими вазоактивными препаратами при лечении пациентов с проявлениями перемежающейся хромоты. Существует обширная доказательная база относительно безопасности длительного назначения цилостазола.
Ключевые слова: цилостазол, перемежающаяся хромота, лечение, доказательная медицина.
SPECIAL ROLE OF CILOSTAZOL IN PATIENTS WITH INTERMITTENT CLAUDICATION TREATMENT ACORDING TO THE EVIDENCE-BASED MEDICINE RECOMMENDATIONS
I.M. Gudz
Ivano-Frankivsk National Medical University
The analysis of evidence-based medicine data concerning conservative treatment for patients with peripheral occlusive disease in the stage of intermittent claudication was done. The numerous studies data advocates the cilostazol pathogenetic advisability for these patients treatment is presented. Multicenter randomized placebo-controlled trials results indicate the cilostazol clinical and economic benefits above pentoxifyllin and other vasoactive drugs in the treatment for patients with intermittent claudication manifestations. Extensive evidence base concerning safety of long-term cilostazol appointment is approachable.
Key words: cilostazol, intermittent claudication, treatment, evidence-based medicine.
Нині у лікувальній тактиці щодо пацієнтів з виявами переміжної кульгавості (ПК) чинними залишаються рекомендації другого Трансатлантичного міждисциплінарного консенсусу (TASC II, 2007) [14]. Згідно з цим документом, наявність ПК як вияв периферійного оклюзійного захворювання констатують у 3 % осіб віком понад 40 років та у 6 % осіб віком понад 60 років. Результати популяційних досліджень свідчать про те, що у 10—50 % таких хворих ПК не обмежує повсякденну діяльність і не є приводом для звернення до лікаря. На рисунку представлено 5-річну перспективу для пацієнтів з облітерувальним атеросклерозом і зокрема ПК.
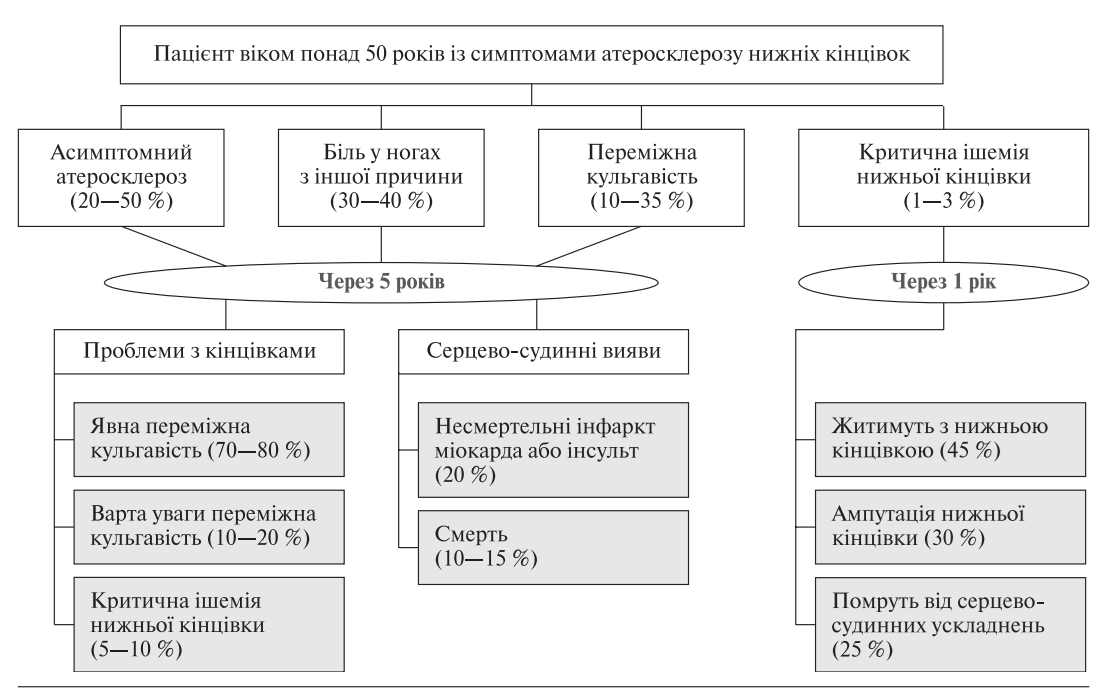 Рисунок. Перебіг облітерувального атеросклерозу в пацієнтів з переміжною кульгавістю протягом 5 років (за даними асоціацій судинних спеціалістів)
Рисунок. Перебіг облітерувального атеросклерозу в пацієнтів з переміжною кульгавістю протягом 5 років (за даними асоціацій судинних спеціалістів)
При виборі лікувальної тактики для пацієнтів з ПК слід ураховувати потребу в корекції наявних чинників ризику розвитку кардіоцеребральних ускладнень, а також застосовувати підходи, які ґрунтуються на: 1) об’єктивних показниках збільшення дистанції безбольової ходьби на біговій доріжці; 2) суттєвому поліпшенні якості життя за різноманітними опитувальниками (рекомендація 13 TASC II). Одна з ефективних і перевірених часом лікувальних методик, яка рекомендується зазначеним консенсусом насамперед для пацієнтів з ПК — дозована ходьба на біговій доріжці (рівень доказів А). При цьому вправи повинні бути достатньої ефективності аж до розвитку кульгавості, тривалість сеансу — 30—60 хв тричі на тиждень упродовж 3 міс (рівень доказів В). Водночас пацієнти з виявами ПК мають отримувати медикаментозну терапію, яка здатна поліпшити кровоплин в артеріях нижніх кінцівок. У консенсусі наведено результати аналізу ефективності застосування різних вазоактивних препаратів у пацієнтів з виявами ПК. Метааналізи рандомізованих досліджень установили, що доведеною є ефективність лише двох препаратів — цілостазолу та нафтидрофурилу. Рекомендовано проводити 3—6-місячні курси прийому цілостазолу як фармакотерапію вибору для пацієнтів з ПК. Про ефективність свідчить подовження дистанції безбольової ходьби на біговій доріжці та поліпшення якості життя (рівень доказів А).
Мета роботи — проаналізувати дані літератури щодо різноманітних аспектів застосування цілостазолу для лікування пацієнтів з виявами переміжної кульгавості.
Цілостазол (cilostazol) — похідний хінолінону, який інгібує фосфодіестеразу третього типу з підвищенням вмісту цАМФ у тромбоцитах, гладеньких м’язах судин, ендотеліальних клітинах. Основними наслідками такого впливу є виражене пригнічення активації/агрегації тромбоцитів, зменшення ризику тромбозу, збільшена продукція окису азоту та вазодилатація. Окрім цього, в експериментах було показано, що цілостазол має здатність гальмувати проліферацію гладеньком’язових клітин, підвищувати вміст у крові ліпопротеїнів високої щільності і зменшувати рівень тригліцеридів, сприяти ангіогенезу та гальмувати запальні процеси [4, 8, 11]. Цілостазол гальмує агрегацію тромбоцитів більшою мірою, ніж ацетилсаліцилова кислота, а також має вираженіший дезагрегантний ефект, ніж тиклопідин (при цьому тривалість кровотечі не подовжується) [10]. Селективне пригнічення агрегації тромбоцитів під дією цілостазолу не супроводжується його впливом на синтез простацикліну і не спричиняє пригнічення функції ендотеліальних клітин.
На особливу увагу заслуговують дослідження, в яких показано позитивний вплив цілостазолу на порушений обмін ліпідів. Так, T. M. Lee і співавт. виявили, що після 12 тиж прийому препарату рівень ліпопротеїнів високої щільності зростав на 10 %, а тригліцеридів — знизився на 15 % [11]. Позитивний ефект від прийому цілостазолу починав виявлятися через 2 тиж після початку лікування. При цьому рівень загального холестерину та ліпопротеїнів низької щільності не змінювався. S. Manickavasagam та співавт. в експерименті на тваринах з гіперхолестеринемією моделювали інфаркт міокарда, а потім проводили лікування аторвастатином або комбінацією цілостазолу та аторвастатину. Установлено, що після додаткового введення цілостазолу збільшувалася продукція вазодилататора оксиду азоту і зменшувався розмір зони ішемії [13], можливо, за рахунок здатності цілостазолу стимулювати вироблення ендотеліального фактора росту з посиленням процесів ангіогенезу [11]. Цілостазол також має здатність пригнічувати запальні процеси при хронічних захворюваннях. Досить показовими в цьому відношенні є результати досліджень N. K. Agrawal та співавт. [1]. Дослідники обстежували хворих на гіпертонічну хворобу, поєднану із цукровим діабетом, і вивчали у них зміни рівня таких маркерів запалення, як високочутливий С-реактивний білок та малоновий діальдегід. Установлено, що цілостазол може гальмувати оксидантний стрес і запальні процеси: його додаткове призначення у терапевтичній дозі сприяло зниженню вмісту С-реактивного білка на 24 %, а малонового діальдегіду — на 18 % (в обох випадках р < 0,001) вже через 1 міс після початку лікування.
Доведені в експериментальних та клінічних дослідженнях позитивні ефекти цілостазолу щодо посилення артеріального кровоплину дали підстави для його широкого впровадження у клінічну практику. Офіційно цілостазол був дозволений FDA (Управління із санітарного нагляду за якістю харчових продуктів та медикаментів, США) у 1999 р. для лікування пацієнтів з ПК. Того ж року були опубліковані результати багатоцентрового рандомізованого подвійного сліпого плацебоконтрольованого дослідження в паралельних групах нового фармакологічного лікування ПК [2]. 663 пацієнти з виявами ПК були розподілені на три групи залежно від терапії: прийом протягом 6 міс цілостазолу в дозі 200 мг чи 100 мг на добу або плацебо. Вивчено зміни максимальної та безбольової дистанції ходьби, а також якості життя. Констатовано, що наприкінці дослідження у першій групі (200 мг) дистанція максимальної ходьби подовжилася на 51 %, у другій (100 мг) — на 38 % порівняно з групою плацебо (в обох випадках р < 0,001). Безбольова дистанція збільшилася відповідно на 59 та 48 % (в обох випадках р < 0,001). Ці результати корелювали з позитивними змінами якості життя та функціонального стану.
Протягом 3 років від впровадження в клінічнупрактику цілостазолу вже проведено метааналізи багатьох рандомізованих досліджень. Так, J. G. Regensteiner і співавт. проаналізували 6 досліджень ефекту цілостазолу порівняно з плацебо у пацієнтів з виявами ПК: через 12—24 міс від початку лікування навантажувальний тредміл-тест у 749 пацієнтів засвідчив подовження максимальної дистанції ходьби на 76 %, у групі плацебо — на 20 %; ступінчастий тредміл-тест у 895 пацієнтів засвідчив подовження максимальної дистанції ходьби під впливом цілостазолу на 40 %, у групі плацебо — на 20 % (р < 0,05) [16]. Дослідники провели статистичний аналіз отриманих даних і дійшли висновку, що цілостазол у дозі 100 мг двічі на добу статистично достовірно подовжував дистанцію як максимальної ходьби, так і безбольової. Згідно з опитувальником SF-36 установлено функціональне та загальне поліпшення стану пацієнтів під впливом препарату. Клінічні ефекти цілостазолу виникали через 4 тиж після початку лікування, а проведений метааналіз виявив доцільність проведення 12—24-тижневого курсу лікування.
Отримані в плацебоконтрольованих дослідженнях позитивні результати внаслідок застосування цілостазолу в пацієнтів з ПК спонукали до якісно нового рівня досліджень — перевірки його ефективності порівняно з іншими вазоактивними препаратами. Оскільки раніше при лікуванні ПК було доведено ефективність пентоксифіліну (дозволений FDA для лікування хворих із симптомами ПК), порівняння проводили з цим препаратом. D. L. Dawson і співавт. опублікували у 2000 р. результати рандомізованого подвійного сліпого багатоцентрового дослідження. У 54 судинних центрах обстежено 922 пацієнтів з виявами ПК, які були розподілені на три групи (цілостазол у дозі 100 мг двічі на добу, пентоксифілін у дозі 400 мг тричі на добу, плацебо) [5]. Через 24 міс після початку прийому досліджуваних препаратів збільшення середньої максимальної дистанції ходьби становило для цілостазолу 107 м (збільшення на 54 %; р < 0,001), для пентоксифіліну — 64 м (збільшення на 30 %; р < 0,05), у групі плацебо — на 72 м (збільшення на 34 %; р < 0,05).
Результати іншого дослідження, проведеного в Іспанії, також засвідчили збільшення дистанції ходьби під впливом цілостазолу на 72 % порівняно з пентоксифіліном та на 34 % порівняно з нафтидрофурилом [3]. При цьому витрати на лікування пацієнтів із ПК при використанні цілостазолу були нижчими на 11,5 % порівняно з пентоксифіліном та на 11,2 % порівняно з нафтидрофурилом. Детальніший аналіз результатів цього дослідження виявив, що затрати на 1 % подовження максимальної дистанції ходьби становили відповідно 7,8; 9,1 та 14,7 євро (тобто цілостазол виявився економічно вигіднішим медикаментом для лікування ПК у країнах Євросоюзу). Економічні переваги застосування цілостазолу при ПК виявлено у США (порівняно з пентоксифіліном) [17] і у Великій Британії [6]. Певний інтерес щодо порівняльних властивостей цілостазолу та пентоксифіліну становить інформація, наведена у пошуковій системі Medify.com. Висновки ґрунтуються на результатах 2545 досліджень (525 998 пацієнтів), висновках FDA, а також 27 дискусій пацієнтів з ПК. Обидва препарати ефективні для лікування ПК, проте позитивні наслідки від застосування пентоксифіліну констатовано у 186 із 217 досліджень (15 551 пацієнт), від цілостазолу — у 133 із 137 досліджень (49 056 пацієнтів). Таким чином, частка позитивного результату для пентоксифіліну становила 85,7 %, для цілостазолу — 97,1 %. Попри переваги цілостазолу над пентоксифіліном щодо подовження дистанції ходьби, перший володіє властивостями впливати на порушений обмін ліпідів. Так, T. M. Lee і співавт. встановили у паралельних групах подовження дистанції ходьби, проте цілостазол на відміну від пентоксифіліну підвищував рівень ліпопротеїнів високої щільності та знижував вміст інтерлейкіну-6 (зниження рівня останнього позитивно впливає на обмін ліпідів) [11].
Для лікування ПК можуть бути використані й інші препарати: у системному огляді літератури та метааналізі M. Hashiguchi і співавт. наведено результати ефективності використання цілостазолу, берапросту та простагландину Е1 у пацієнтів з ПК [7]. Дослідники дійшли висновку про доцільність застосування цілостазолу та простагландину Е1 у цієї категорії хворих, проте використання простагландину Е1 асоціюється з більшим ризиком побічних ефектів.
Надаючи дозвіл для застосування цілостазолу, FDA вказувала на можливі ризики за наявності супутньої серцевої патології (виражена серцева недостатність). Аналіз 4 досліджень засвідчив відсутність суттєвої відмінності у частоті інфаркту міокарда, інсульту чи смерті у групах цілостазолу та плацебо [15]. У двох дослідженнях констатовано, що кількість кардіоваскулярних подій та випадків смерті у групі цілостазолу у дозі 200 мг на добу була на 7 % нижчою, ніж у групі плацебо, а в групі цілостазолу в дозі 100 мг — на 6 %. Проте автори не рекомендують призначати цілостазол хворим з ПК у поєднанні із вираженою серцевою недостатністю. Відносно частими, але без загроз, побічними ефектами цілостазолу (судинорозширювальний ефект) можуть бути головні болі та розлади моторики шлунково-кишкового тракту. Тривале рандомізоване сліпе плацебоконтрольоване постмаркетингове дослідження безпечності цілостазолу проведено за участю 1439 пацієнтів у США, Японії, Великій Британії, а також у країнах Азії та Південної Америки [9]. Як первинну кінцеву точку обрано смертність, яка виявилася значно нижчою, ніж очікувана. Через 3 роки дослідження припинили, оскільки у групі цілостазолу констатовано 49 смертей (12 — серцевого походження), а в групі плацебо — 52 смерті (13 — серцевого походження). Кількість кардіоваскулярних подій (інфаркт міокарда, інсульт), становила 135 у групі цілостазолу та 153 — у групі плацебо. Наведені дані свідчать про безпечність цілостазолу щодо ризику серцево-судинних подій. Високу безпечність лікування цілостазолом відзначили також N. J. Leeper і співавт. [12], які провели аналіз даних 1,8 млн пацієнтів з клінічної електронної бази Стенфорду і порівняли групу з 232 хворих з ПК, які приймали цілостазол, із групою з 1160 пацієнтів, яких лікували без цього препарату. Спостереження за обома групами протягом 4,2 року не виявило взаємозв’язку між прийомом цілостазолу та великими кардіоваскулярними подіями (інфаркт міокарда, інсульт або смерть), а також збільшенням частоти аритмій. На сайті Medify.com можна знайти порівняльну характеристику безпечності цілостазолу та пентоксифіліну: 57 із 60 досліджень (51 019 пацієнтів) засвідчили, що цілостазол є безпечним препаратом, 47 із 50 досліджень (7817 пацієнтів) — що пентоксифілін.
Властивості препарату пригнічувати активацію/агрегацію тромбоцитів, зменшувати ризик тромбозу, стимулювати продукцію оксиду азоту та вазодилатацію, гальмувати проліферацію гладеньком’язових клітин, підвищувати вміст у крові ліпопротеїнів високої щільності і зменшувати рівень тригліцеридів, сприяти ангіогенезу та гальмувати запальні процеси патогенетично обґрунтовують доцільність його призначення для лікування пацієнтів з облітерувальним атеросклерозом.
Згідно з даними доказової медицини (численні рандомізовані дослідження), цілостазол є препаратом вибору для лікування пацієнтів з виявами ПК. При цьому він має суттєві як клінічні, так і економічні переваги над пентоксифіліном та нафтидрофурилом.
Велика клінічна база даних (масштабні постмаркетингові дослідження) засвідчила безпечність тривалого прийому цілостазолу щодо ризику виникнення серйозних побічних ефектів.
Література
- Agrawal N. K., Maiti R., Dash D., Pandey B. L. Cilostazol reduces inflammatory burden and oxidative stress in hypertensive type 2 diabetes mellitus patients // Pharmacol Res. — 2007. — Vol. 56 (2). — P. 118—123.
- Beebe H. G., Dawson D. L., Cutler B. S. et al. A new pharmacological treatment for intermittent claudication: results of a randomized, multicenter trial // Arch. Intern. Med. — 1999. — Vol. 159 (17). — P. 2041—2050.
- Brossa M., Garcia-Cases C., Clerch L. et al. Cost-effectiveness analysis of cilostazol vs naftidrofuryl and pentoxifilline for the treatment of intermittent claudication in Spain // — 2011. — Vol. 63 (3). — P. 103—107.
- Chapman T. M, Goa K. L. Review Cilostazol: a review of its use in intermittent claudication // Am. J. Cardiovasc. Drugs. — 003. — Vol. 3 (2). — P. 117—138.
- Dawson D. L., Cutler B. S., Hiatt W. R. A comparison of cilostazol and pentoxifylline for treating intermittent claudication // Am. J. Med. — 2000. — Vol. 109. — P. 523—530.
- Guest J. F., Davie A. M., Clegg J. P. Cost effectiveness of cilostazol compared with naftidrofuryl and pentoxifylline in the treatment of intermittent claudication in the UK // Curr. Med. Res. Opin. — 2005. — Vol. 21 (6). — P. 817—826.
- Hashiguchi M., Ohno K., Saito R.Studies on the effectiveness and safety of cilostazol, beraprost sodium, prostaglandin E1 for the treatment of intermittent claudication // Yakugaku Zasshi. — 2004. — Vol. 124 (6). — P. 321—332.
- Hashimoto A., Miyakoda G., Hirose Y., Mori T. Activation of endothelial nitric oxide synthase by cilostazol via a cAMP/protein kinase Aand phosphatidylinositol 3-kinase/Akt-dependent mechanism // Atherosclerosis. — 2006. — Vol. 189 (2). — P. 350—357.
- Hiatt W.R. The US experience with cilostazol in treating intermittent claudication // Atheroscler Suppl. — 2006. — Vol. 6. — P. 21—31.
- Ikeda Y., Kikuchi M., Murakami H. et al. Comparison of the inhibitory effects of cilostazol, acetylsalicylic acid and ticlopidine on platelet functions ex vivo. Randomized, double-blind cross-over study // Arzneimittelforschung. — 1987. — Vol. 37 (5). — P. 563—566.
- Lee T.M., Su S. F., Hwang J. J. et al. Differential lipogenic effects of cilostazol and pentoxifylline in patients with intermittent claudication: potential role for interleukin-6 // Atherosclerosis. — 2001. — Vol. 158 (2). — P. 471—476.
- Leeper N.J., Bauer-Mehren A., Iyer S. V. et al. Practice-based evidence: profiling the safety of cilostazol by text-mining of clinical notes // PLoS One. — 2013. — Vol. 8 (5). — P. e63499.
- Manickavasagam S., Ye Y., Lin Y., Perez-Polo R. J. et al. The cardioprotective effect of a statin and cilostazol combination: relationship to Akt and endothelial nitric oxide synthase activation // Cardiovasc. Drugs Ther. — 2007. — Vol. 21 (5). — P. 321—330.
- Norgren L., Hiatt W. R., Dormandy J. A. et al. On bahalf of the TASC II Working group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) // J. Vasc. Surg. — 2007. — Suppl. 1. — P. 5—67.
- Pratt C.M. Analysis of the cilostazol safety database // Am. J. Cardiol. — 2001. — Vol. 87. — P. 28D–33D.
- Regensteiner G., Ware J. E. Jr., McCarthy W. J. et al. Effect of cilostazol on treadmill walking, community-based walking ability, and health-related quality of life in patients with intermittent claudication due to peripheral arterial disease: meta-analysis of six randomized controlled trials // J. Am. Geriatr. Soc. — 2002. — Vol. 50 (12). — P. 1939—1946.
- Tjon A., Riemann L. E. Treatment of intermittent claudication with pentoxifylline and cilostazol // Am. J. Health Syst. Pharm. — 2001. — Vol. 58 (6). — P. 485—493.
Хірургія України.— 2014.— № 1.— С. 107—111.






