Продукція
Препарати зареєстровані в Україні
УДК 616.8-009.188.4-085.273+615.273
Особлива роль цілостозолу в лікуванні пацієнтів із проявами «переміжної» кульгавості згідно рекомендацій доказової медицини
І.М.Гудз
Івано-Франківський національний медичний університет
На даний час в плані лікувальної тактики щодо пацієнтів із проявами «переміжної» кульгавості (ПК) діючими залишаються рекомендації визнаного у всьому світі другого Трансатлантичного Міждисциплінарного Консенсусу (TASC II, 2007) [14]. Згідно вказаного документу, наявність ПК як прояву периферійного оклюзійного захворювання, констатують у 3% людей старше 40 років та у 6% - після 60 років. В той же час різні популяційні дослідження вказують на те, що у 10-50% таких хворих ПК не обмежує в житті і не спонукає до лікарського обстеження. На діаграмі 1 представлено 5-річну перспективу для пацієнтів із облітеруючим атеросклерозом та ПК, зокрема.
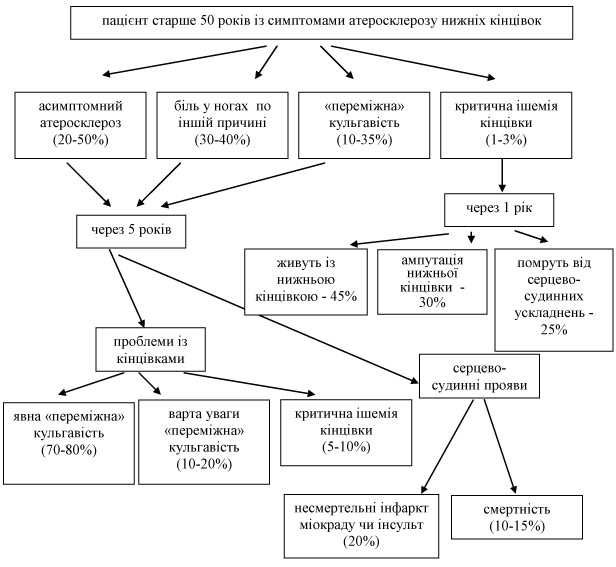
Діаграма 1. Подальший перебіг облітеруючого атеросклерозу у пацієнтів із «переміжною» кульгавістю на протязі 5 років (за даними світових асоціацій судинних спеціалістів).
При виборі лікувальної тактики для пацієнтів із ПК слід враховувати потребу у корекції наявних факторів ризику розвитку кардіо-церебральних ускладнень, а також застосовувати такі підходи, які грунтуються: 1) на об’єктивних показниках збільшення дистанції безбольової ходьби на біговій доріжці; 2) суттєве покращення якості життя у різноманітних опитувальниках (рекомендація 13 TASC II). Одна із достатньо ефективних і перевірених часом лікувальних методик, яка рекомендується згаданим консенсусом в першу чергу для пацієнтів із ПК, є дозована ходьба на біговій доріжці (ступінь доказовості А). При цьому вправи повинні бути достатньої ефективності аж до розвитку кульгавості і тривалість сеансу складає 30-60 хв, при частоті тричі на тиждень впродовж 3 міс (ступінь доказовості В). В той же час пацієнти із проявами ПК повинні отримувати і медикаментозну терапію, яка здатна покращити кровоплин у артеріях нижніх кінцівок. Вищезгаданий консенсус провів глибокий аналіз щодо ефективності застосування різноманітних вазоактивних препаратів у пацієнтів із проявами ПК. Мета-аналізи рандомізованих досліджень засвідчили, що доказаною була користь від застосування тільки двох препаратів – цілостазолу та нафтідрофурилу. Особлива роль відводиться все ж таки цілостазолу у вигляді наступної рекомендації: 3-6 місячні курси прийому цілостазолу повинні бути фармакотерапією вибору для пацієнтів із ПК, що підтверджується подовженням безбольової ходьби на біговій доріжці та поліпшенням якості життя (ступінь доказовості А).
Виходячи із високого рівня вищенаведеної рекомендації, метою даної роботи було проаналізувати літературні дані щодо різноманітних аспектів застосування цілостазолу (ЦС) при лікуванні пацієнтів із проявами ПК.
ЦС (cilostazol) представляє собою похідний хінолінону, який інгібує фосфодіестеразу третього типу із наступним підвищенням вмісту цАМФ у тромбоцитах, гладких мʼязах судин, ендотеліальних клітинах. Основними наслідками такого впливу є виражене пригнічення активації/агрегації тромбоцитів, зменшення ризику тромбозу, збільшена продукція окису азоту та вазодилятація. Окрім цього, в експериментах було показано, що ЦС має здатність гальмувати проліферацію гладкомʼязових клітин, підвищувати вміст в крові ліпопротеїідів високої щільності і зменшувати - тригліцеридів, а також сприяти ангіогенезу та гальмувати запальні процеси [4,8,11]. Було показано, що ЦС гальмує в більшій ступені агрегацію тромбоцитів ніж ацетилсаліцилова кислота, а також має вираженіший дезагрегантний ефект ніж тіклопідин (при цьому час кровотечі не подовжується) [10]. Селективна інгібіція агрегації тромбоцитів під дією ЦС не супроводжується його впливом на синтез простацикліну і не веде до пригнічення функції ендотеліальних клітин.
Особливої уваги заслуговують дослідження, в яких було показано позитивний вплив ЦС на порушений обмін ліпідів. Так, T.M.Lee et al. констатували, що після 12 тижнів прийому ЦС рівень ліпопротеїдів високої щільності зростав на 10%, а вміст тригліцеридів – знизився на 15% [11]. Позитивний ефект від прийому ЦС, за даними дослідників, вже починав проявлятися через 2 тижні від початку лікування. В той же час не відбувалось змін у рівнях загального холестерину та ліпопротеїдів низької щільності. S.Manickavasagam et al. в експерименті на гіперхолестеринемічних тваринах моделювали інфаркт міокарду, а потім проводили лікування атровастатином або комбінацією ЦС+аторвастатин: було встановлено, що від додаткового введення ЦС наростала продукція вазодилятатора окису азоту і зменшувались розміри зони ішемії [13]. Щодо останнього факту, то можливо зменшення зони ішемії відбувалось за рахунок здатності ЦС стимулювати вироблення ендотеліального фактору росту із наступним посиленням процесів ангіогенезу [11]. Слід також наголосити на ще одній позитивній властивості ЦС – здатності пригнічувати запальні процеси при хронічних захворюваннях. Досить аргументованими в цьому відношенні є результати досліджень N.K.Agrawal et al. [1]. Дослідники обстежували хворих на гіпертонічну хворобу, поєднану із цукровим діабетом, і вивчали у них зміни таких маркерів запалення, як високочутливий С-реактивний білок та малоновий діальдегід. Було показано, що ЦС може гальмувати оксидативний стрес та запальні процеси: його додаткове призначення у терапевтичній дозі вказаним пацієнтам призводило до зниження вмісту С-реактивного білка на 24%, а малонового діальдегіду – на 18% (в обох випадках Р<0,001) вже через 1 місяць від початку лікування.
Доказані в експериментальних та клінічних дослідженнях позитивні ефекти ЦС стосовно посилення артеріального кровоплину послужили підґрунтям для його широкого впровадження у клінічну практику. Офіційно ЦС був дозволений FDA (Управління з санітарного нагляду за якістю харчових продуктів та медикаментів, США) у 1999 році для лікування пацієнтів із «переміжною» кульгавістю (ПК). В цьому ж році були опубліковані результати багатоцентрового, рандомізованого, подвійно-засліпленого, плацебо-контрольованого в паралельних групах дослідження щодо нового фармакологічного лікування ПК [2]. 663 пацієнти із проявами ПК були поділені на 3 групи залежно від того приймали вони протягом 6 міс ЦС в дозі 200мг чи 100мг на день або плацебо, вивчались зміни максимальної та безбольової дистанції ходьби, а також якості життя. Було констатовано, що на кінець дослідження пацієнти першої групи (200мг) засвідчили подовження дистанції ходьби на 51%, другої (100мг) – на 38% більше ніж в групі плацебо (в обох випадках Р<0,001). Безбольова ж дистанція наростала відповідно на 59% та 48% (в обох випадках Р<0,001). Ці результати корелювали із позитивною оцінкою змін якості життя та функціонального стану. На протязі 3 років від моменту впровадження в клінічну практику ЦС були вже проведені мета-аналізи багатьох рандомізованих досліджень. Так, J.G.Regensteiner et al. проаналізували 6 досліджень щодо вивчення ефекту ЦС порівняно із плацебо у пацієнтів із проявами ПК: через 12-24 міс від початку лікування ЦС навантажувальний тредміл-тест у 749 пацієнтів засвідчив подовження максимальної дистанції ходьби на 76%, у групі плацебо даний показник склав 20%; в той же час ступінчастий тредміл-тест у 895 пацієнтів засвідчив подовження максимальної дистанції ходьби під впливом ЦС на 40%, у групі ж плацебо – на 20% (Р<0,05) [16]. Дослідники провели більш глибокий статистичний аналіз отриманих даних і зробили висновок, що ЦС в дозі 100мг двічі на день статистично достовірно подовжував дистанцію як максимальної ходьби, так і безбольової. Опитувальник SF-36 також допоміг констатувати функціональне та загальне покращення стану обстежуваних під впливом ЦС. Клінічні ефекти від ЦС починали проявлятися вже через 4 тижні від початку лікування, а проведений мета-аналіз вказав на доцільність проведення 12-24 тижневого курсу лікування.
Отримані в плацебо-контрольованих дослідженнях позитивні результати від застосування ЦС у пацієнтів із ПК спонукали до якісно нового рівня досліджень – перевірки його ефективності у порівнянні із іншими вазоактивними препаратами. Оскільки раніше при лікуванні ПК була доказана ефективність пентоксифілліну (ПФ, також дозволений FDA для лікування хворих із симптомами ПК), то проводились і відповідні порівняльні дослідження. Так, D.L.Dawson et al. представили у 2000 році результати рандомізованого подвійно-сліпого, багатоцентрового дослідження: у 54 судинних центрах було обстежено 922 пацієнта із проявами ПК, які були поділені на три групи (ЦС 100мг двічі на день, ПФ 400мг тричі на день, плацебо) [5]. Через 24 міс від початку прийому досліджуваних препаратів наростання середньої максимальної дистанції ходьби склала для ЦС 107 метрів (збільшення на 54%, Р<0,001), ПФ – 64 метри (збільшення на 30%, Р<0,05), а в групі плацебо – на 72 метри (збільшення на 34%, Р<0,05). Результати іншого дослідження, проведеного в Іспанії, також засвідчили збільшення дистанції ходьби під впливом ЦС на 72% порівняно із ПФ та на 34% - із нафтідрофурилом [3]. При цьому фінансові затрати на лікування пацієнтів із ПК при використанні ЦС були нижчі на 11,5% ніж при ПФ та на 11,2% - ніж при застосуванні нафтідрофурилу. Більш детальний аналіз результатів цього дослідження вказав, що на 1% подовження максимальної дистанції ходьби затрати склали відповідно – 7,8€, 9,1€ та 14,7€ (тобто ЦС виявився ще й економічно більш вигідним медикаментом для лікування ПК в умовах Євросоюзу). Щодо економічних переваг застосування ЦС (порівняно із ПФ) при ПК результативними виявились і дослідження, проведені у США групою вчених на чолі із J.A.Tjon [17]. Також ЦС був більш економічним для лікування симптомів ПК в системі охорони здоров’я Великобританії [6]. Певний інтерес щодо порівняльних властивостей ЦС та ПФ представляє інформація, яка наводиться у пошуковій системі Medify.com. Відмічається, що порівняльні результати застосування ЦС та ПФ грунтуються на даних 2545 досліджень (525998 пацієнтів), заключеннях FDA, а також 27 дискусій пацієнтів із ПК. Констатується, що обидва препарати є ефективними для лікування проявів ПК, проте позитивні наслідки від застосування ПФ були виявлені у 186 із 217 досліджень (15551 пацієнтів), в той час як від ЦС – у 133 із 137 досліджень (49056 пацієнтів). Таким чином, частка позитивного результату для ПФ склала 85,7%, в той час як для ЦС – 97,1%. Попри переваги ЦС над ПФ щодо подовження дистанції ПК, перший на відміну від ПФ володіє і вже згаданими властивостями впливати на порушений обмін ліпідів. Так, T.M.Lee et al. встановили у порівняльних групах подовження дистанції ПК, проте ЦС, на відміну від ПФ, викликав підвищення рівнів ліпопротеїдів високої щільності та зниження вмісту інтерлейкіну-6 (зниження останнього позитивно впливає на обмін ліпідів) [11].
Для лікування ПК можуть використовуватись й інші препарати: у системному огляді літератури та мета-аналізі M.Hashiguchi et al. наводяться результати ефективності використання ЦС, берапросту та простагландину Е1 у пацієнтів із ПК [7]. Дослідники роблять висновок про доцільність застосування ЦС та простагландину Е1 у вказаної категорії хворих, проте використання останнього пов’язана із більшим ризиком побічних ефектів.
Представлені вище позитивні результати застосування ЦС для лікування пацієнтів із проявами ПК викликають резонне запитання про безпечність даного препарату (ризик побічних ефектів). У цьому відношенні можна теж навести ряд аргументованих досліджень, які вказують на доцільність широкого використання ЦС в клінічній практиці. При дозволі для застосування даного препарату FDA вказувала на можливі ризики при наявності супутньої серцевої патології (виражена серцева недостатність). Аналіз 4 досліджень засвідчив, що не було суттєвої відмінності щодо частоти інфаркту міокарду, інсульту чи смерті у групах ЦС та плацебо [15]. Мало того, у двох дослідженнях констатовано, що число кардіоваскулярних подій та смертності у групі ЦС із дозою 200мг на день було на 7% нижче, а в групі ЦС 100мг – на 6% нижче ніж в групі плацебо. Проте автори не рекомендують призначати ЦС хворим, які мають ПК у поєднанні із вираженою серцевою недостатністю. Відносно частими, але без загроз, побічними ефектами ЦС (судиннорозширюючий ефект) можуть бути головні болі та розлади моторики шлунково-кишкового тракту. Довгострокове рандомізоване засліплене плацебо-контрольоване постмаркетингове дослідження щодо безпечності ЦС було проведене на 1439 пацієнтах у США, Японії, Великобританії, а також країнах Азії та Південної Америки [9]. Як первинна кінцева точка розглядалась смертність, яка виявилась значно нижчою ніж очікувалось і це дозволило вже через 3 роки припинити дослідження: у групі ЦС констатовано 49 смертей (12 серцевого походження), а в групі плацебо - 52 смерті (13 серцевого походження). Коли ж порахували кількість кардіоваскулярних подій (інфаркти міокарду, інсульти), то виявилось таких 135 у групі ЦС та 153 – плацебо. Дані результати дають значні гарантії стосовно серцево-судинної безпеки ЦС. Високу безпечність лікування ЦС відмітили також N.J.Leeper et al. [12]. Дослідниками було проведено аналіз 1,8 млн пацієнтів клінічної електронної бази Стенфорду і порівняно групу 232 хворих із ПК, які приймали ЦС із групою 1160, яких лікували без даного препарату. Спостереження за обома групами протягом 4,2 років не виявило взаємозв’язку між прийомом ЦС та великими кардіоваскулярними ускладненнями (інфаркт міокарду, інсульт чи смерть), а також зі збільшенням частоти аритмій. В завершення щодо безпечності ЦС слід знову звернутись до пошукової системи Medify.com. На даному сайті можна знайти порівняльну характеристику безпечності ЦС та ПФ: 57 із 60 досліджень (51019 пацієнтів) засвідчили, що ЦС є безпечним медикаментом, в той час як для ПФ доказова база безпечності ґрунтується на даних 47 із 50 досліджень (7817 пацієнтів).
Таким чином, наведені вище дані дозволяють зробити наступні висновки щодо ролі ЦС в лікуванні пацієнтів із проявами ПК:
- Властивості ЦС пригнічувати активацію/агрегацію тромбоцитів, зменшувати ризики тромбозу, стимулювати продукцію окису азоту та вазодилятацію, гальмувати проліферацію гладкомʼязових клітин, підвищувати вміст в крові ліпопротеїдів високої щільності і зменшувати - тригліцеридів, сприяти ангіогенезу та гальмувати запальні процеси патогенетично обґрунтовують доцільність його призначення для лікування пацієнтів із облітеруючим атеросклерозом.
- Гуртуючись на даних доказової медицини (чисельні рандомізовані дослідження), ЦС є препаратом вибору для лікування пацієнтів із проявами ПК. При цьому він володіє суттєвими як клінічними, так і економічними перевагами над пентоксифілліном та нафтідрофурилом.
- Наявна велика клінічна база даних (обширні постмаркетингові дослідження), які засвідчили високу безпечність тривалого прийому ЦС в плані ризику виникнення серйозних побічних ефектів.
Література
- Agrawal N.K., Maiti R., Dash D., Pandey B.L. Cilostazol reduces inflammatory burden and oxidative stress in hypertensive type 2 diabetes mellitus patients // Pharmacol Res. 2007 Aug; 56(2):118-23.
- Beebe H.G., Dawson D.L., Cutler B.S., Herd J.A., Strandness D.E.Jr, Bortey E.B., Forbes W.P.A new pharmacological treatment for intermittent claudication: results of a randomized, multicenter trial // Arch Intern Med. 1999 Sep 27;159(17):2041-50.
- Brossa M., Garcia-Cases C., Clerch L., March J.R., Lozano F.S. Cost-effectiveness analysis of cilostazol vs naftidrofuryl and pentoxifilline for the treatment of intermittent claudication in Spain // Angiologia. 2011; 63(3):103-7.
- Chapman T.M, Goa K.L. Review Cilostazol: a review of its use in intermittent claudication // Am J Cardiovasc Drugs. 2003; 3(2):117-38.
- Dawson D.L., Cutler B.S., Hiatt W.R. A comparison of cilostazol and pentoxifylline for treating intermittent claudication // Am J Med. 2000;109:523–30.
- Guest J.F., Davie A.M., Clegg J.P. Cost effectiveness of cilostazol compared with naftidrofuryl and pentoxifylline in the treatment of intermittent claudication in the UK // Curr Med Res Opin. 2005 Jun;21(6):817-26.
- Hashiguchi M., Ohno K., Saito R. Studies on the effectiveness and safety of cilostazol, beraprost sodium, prostaglandin E1 for the treatment of intermittent claudication // Yakugaku Zasshi. 2004 Jun;124(6):321-32.
- Hashimoto A., Miyakoda G., Hirose Y., Mori T. Activation of endothelial nitric oxide synthase by cilostazol via a cAMP/protein kinase A- and phosphatidylinositol 3-kinase/Akt-dependent mechanism // Atherosclerosis. 2006 Dec; 189(2):350-7.
- Hiatt WR. The US experience with cilostazol in treating intermittent claudication // Atheroscler Suppl. 2006;6:21–31. Ikeda Y., Kikuchi M., Murakami H., Satoh K., Murata M., Watanabe K., Ando Y.
- Comparison of the inhibitory effects of cilostazol, acetylsalicylic acid and ticlopidine on platelet functions ex vivo. Randomized, double-blind cross-over study // Arzneimittelforschung. 1987 May; 37(5):563-6.
- Lee T.M., Su S.F., Hwang J.J., Tseng C.D., Chen M.F., Lee Y.T., Wang S.S.Differential lipogenic effects of cilostazol and pentoxifylline in patients with intermittent claudication: potential role for interleukin-6 // Atherosclerosis. 2001 Oct; 158(2):471-6.
- Leeper N.J., Bauer-Mehren A., Iyer S.V., Lependu P., Olson C., Shah N.H. Practice-based evidence: profiling the safety of cilostazol by text-mining of clinical notes // PLoS One. 2013 May 23;8(5):e63499.
- Manickavasagam S., Ye Y., Lin Y., Perez-Polo R.J., Huang M.H., Lui C.Y., Hughes M.G., McAdoo D.J., Uretsky B.F., Birnbaum Y. The cardioprotective effect of a statin and cilostazol combination: relationship to Akt and endothelial nitric oxide synthase activation // Cardiovasc Drugs Ther. 2007 Oct; 21(5):321-30.
- Norgren L., Hiatt W.R., Dormandy J.A. et al. On bahalf of the TASC II Working group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) // J vasc Surg. – 2007. – Suppl.1. – P.5-67.
- Pratt C.M. Analysis of the cilostazol safety database // Am J Cardiol. 2001;87:28D–33D.
- Regensteiner J.G., Ware J.E. Jr, McCarthy W.J., Zhang P., Forbes W.P., Heckman J., Hiatt W.R. Effect of cilostazol on treadmill walking, community-based walking ability, and health-related quality of life in patients with intermittent claudication due to peripheral arterial disease: meta-analysis of six randomized controlled trials // J Am Geriatr Soc. 2002 Dec; 50(12):1939-46.
- Tjon J.A., Riemann L.E. Treatment of intermittent claudication with pentoxifylline and cilostazol // Am J Health Syst Pharm. 2001 Mar 15;58(6):485-93; quiz 494-6.






