
 Статья
Статья
 13.04.2025
13.04.2025
Клінічні переваги метформіну: ще один приклад функціонування механізму альтернативного енергетичного субстрату?
Andrea Giaccari, Anna Solini, Simona Frontoni, Stefano Del Prato
Andrea Giaccari
Центр ендокринних та метаболічних захворювань, Фонд Університетської клініки Агостіно Джемеллі IRCCS (Fondazione Policlinico Universitario Agostino Gemelli IRCCS), Рим, Італія;
Кафедра трансляційної медицини та хірургії, Католицький університет Святого Серця (Università Cattolica del Sacro Cuore), Рим, Італія
Anna Solini
Кафедра хірургічної, медичної, молекулярної та критичної патології, Пізанський університет, Піза, Італія
Simona Frontoni
Відділення ендокринології, діабету та метаболізму, Лікарня Фатебенефрателлі при церкві СанДжованні-Калібіта, Рим, Італія;
Кафедра системної медицини Римського університету Тор Вергата, Рим, Італія
Stefano Del Prato
Секція метаболічних захворювань та діабету, кафедра клініко-експериментальної медицини при Пізанському університеті, Піза, Італія
З часів проведення Британського проспективного дослідження цукрового діабету (UKPDS) метформін вважався препаратом першої лінії для пацієнтів із вперше діагностованим цукровим діабетом 2-го типу. Незважаючи на те що прямих доказів з конкретних клінічних досліджень все ще бракує, кілька досліджень показали, що метформін може захищати від супутньої патології, пов’язаної та не пов’язаної з діабетом, у тому числі серцево-судинних, ниркових, неврологічних захворювань та злоякісних новоутворень. За останні десятиліття було висунуто припущення щодо кількох механізмів дії, які могли б пояснювати захисні ефекти метформіну, жоден з яких, проте, не був остаточно визнаним. Однак, точно відомо, що метформін збільшує продукцію лактату, його концентрацію, а, можливо, й окислення. Лактат, який колись вважався побічним продуктом метаболізму, що виробляється у м’язах під час фізичних навантажень або через анаеробіоз, наразі відомий як головний енергетичний «човник», що перерозподіляє цю енергію з «виробничих майданчиків» у ті ділянки, де вона необхідна. Завдяки безпосередньому поглинанню та окисленню лактату, що виробляється в будь-яких інших ділянках, усі органи-мішені швидко отримують основний об’єм енергії, пропускаючи етап гліколізу та його можливі побічні продукти. Саме тому, посилену продукцію лактату (і, як наслідок, його подальше окислення) можна вважати позитивним механізмом дії метформіну, за винятком випадків, коли за певних обставин кількість метформіну та лактату стають надмірними, що збільшує ризик лактоацидозу. Замість того, щоб розглядати спричинену метформіном продукцію лактату як небезпечну, ми пропонуємо подивитися на неї як на механізм, за допомогою якого метформін спричиняє свою можливу захисну дію на серце, нирки та головний мозок, а в деякій мірі — і протипухлинну дію.
Навіть через 60 років після його введення в діабетичну фармакопею метформін і сьогодні залишається одним з головних еволюційних етапів у лікуванні цукрового діабету (ЦД) 2-го типу. Починаючи з Британського проспективного дослідження цукрового діабету (UKPDS) [1], практично усі клінічні протоколи [2, 3] рекомендують призначати метформін у першій лінії лікування ЦД 2-го типу. До загальновідомих переваг цього препарату належать його глюкозознижувальна ефективність, низький ризик гіпоглікемії, помірне зниження маси тіла, можливість легко комбінувати його з майже будь-яким іншим глюкозознижуючим засобом та низька вартість [2]. Більше того, метформін, як правило, добре переноситься, а найпоширенішим його побічним ефектом є діарея. Лактоацидоз, стан, що становить загрозу життю і потенційно пов’язаний із застосуванням метформіну, виникає відносно рідко і зазвичай розвивається на тлі тяжкого загострення захворювання або у сприятливих клінічних умовах [4]. Крім загального сприятливого співвідношення ризиків та користі для цього препарату, деякі спеціалісти припускають, що його позитивні ефекти щодо перебігу ЦД 2-го типу можуть залежати і від інших властивостей метформіну. Вперше про захисний ефект щодо серцево-судинної системи (ССС) повідомляли у дослідженні UKPDS [1], а пізніше у деяких дослідженнях висували гіпотезу про ренопротективний ефект препарату [5]. Досі тривають дискусії щодо ролі метформіну у профілактиці раку та виникненні рецидивів злоякісних утворень [6]. Проведені нещодавно метааналізи дійшли висновку, що метформін суттєво покращує когнітивні дисфункції у пацієнтів з ЦД 2-го типу [7]. У зовсім новій публікації повідомляли результати когортного дослідження, які вказують на зв’язок між застосуванням метформіну та зниженням ризику смертності та повторної госпіталізації після великих хірургічних втручань [8]. Нарешті, застосування метформіну пов’язують зі зниженням смертності у пацієнтів із ЦД та коронавірусною хворобою 2019 (COVID-19) [9]. Незважаючи на накопичення все більшого масиву доказів про сприятливі плейотропні ефекти метформіну, справжні механізми, які б пояснювали всі ці ефекти, залишаються незрозумілими і розпливчастими. Отже, наша мета — провести великий огляд ефектів метформіну з наміром з’ясувати, чи можна сформулювати певну гіпотезу щодо унифікованого механізму, який лежить в основі різносторонніх ефектів цього препарату.
МЕТФОРМІН ТА СС ЗАХИСТ
В епохальному дослідженні UKPDS у пацієнтів, які отримували метформін, порівняно з групою стандартного лікування, ризик настання будь-якої кінцевої точки, пов’язаної з діабетом, знижувався на 32 % (ДІ 95 %: 13–47, P = 0,002), на 42 % — для смерті, пов’язаної з діабетом (9–63, P = 0,017) та на 36 % — для смертності від усіх причин (9–55, P = 0,011). Крім того, метформін виявив більш помітний ефект, ніж хлорпропамід, глібенкламід або інсулін, щодо будь-якої кінцевої точки, пов’язаної з діабетом (Р = 0,0034), смертності від усіх причин (Р = 0,021) та інсульту (Р = 0,032). Захисний ефект по відношенню до ССС був підтверджений протягом 10-річного періоду подальшого спостереження після завершення дослідження, яке показало, що, незважаючи на аналогічний ступінь глікемічного контролю в осіб, які отримували метформін, порівняно з тими, хто отримував стандартну терапію, у перших зберігалося значуще зниження ризику для будь-якої кінцевої точки діабету, пов’язаної з діабетом смерті, смерті від усіх причин та інфаркту міокарда [10]. Незважаючи на ці заохочуючі результати, рандомізованих контрольованих досліджень, спрямованих на підтвердження захисної дії метформіну щодо ССС, все ще замало. На відміну від UKPDS, у дослідженні «Гіперинсулінемія: результати її метаболічних ефектів» (Hyperinsulinemia: the Outcome of its Metabolic Effects; HOME) брали участь пацієнти з ЦД 2-го типу із більш тривалим перебігом захворювання, яким до існуючої інсулінотерапії додавали плацебо або метформін [11]. І хоча це дослідження не продемонструвало значного впливу метформіну на первинну комбіновану кінцеву точку з макрота мікросудинних явищ, воно показало значущі переваги (навіть після коригування на зміни рівня HbA1c, добову дозу інсуліну та систолічний артеріальний тиск) для вторинної макросудинної кінцевої точки з відношенням ризиків 0,34 (95 % ДІ: 0,21–0,56, P = 0,001). У дослідженні, що провели Han et al. [12], за участі пацієнтів з ЦД 2-го типу та ішемічною хворобою серця, які були рандомізовані для лікування метформіном або гліпізидом, було відзначено значущу користь від метформіну за первинною комбінованою СС кінцевою точкою (відношення ризиків 0,54; 95 % ДІ: 0,30–0,90, P = 0,026). Цей захисний ефект для ССС був значною мірою підтверджений, хоча і не скрізь, в обсерваційних дослідженнях. За великим рахунком, ці дослідження показали, що метформін забезпечує більш відчутні переваги для серцево-судинної системи порівняно із змінами способу життя, застосуванням похідних сульфонілсечовини та акарбози [13]. Сприятливі ефекти метформіну спостерігалися для пацієнтів із ЦД 2-го типу із встановленою атеросклеротичною хворобою серця, ішемічною хворобою серця та підвищеними факторами ризику СС захворювань, включаючи куріння, а також пацієнтів із серцевою недостатністю та хронічною хворобою нирок (ХХН) [13]. Сприятливі СС ефекти метформіну можуть поширюватися також на пацієнтів із ЦД 1-го типу, судячи з результатів дослідження щодо зменшення поширеності атеросклеротичних уражень за допомогою метформіну (REducing with MetfOrmin Vascular Adult Lesions; REMOVAL) [14]. У цьому дослідженні метформін не призводив до значущого зменшення прогресуючого збільшення середньої товщини комплексу інтима-медіа сонної артерії (–0,005 мм на рік, 95 % ДІ: від –0,012 до 0,002, Р = 0,1664), що було основною кінцевою точкою дослідження, але максимальна товщина комплексу інтимамедіа сонної артерії (попередньо визначений третинний результат) значно зменшилася (–0,013 мм на рік; від –0,024 до –0,003, Р = 0,0093).
МЕТФОРМІН І НЕФРОПРОТЕКЦІЯ
Певний масив експериментальних даних підтверджують потенційний сприятливий вплив метформіну на нирки. Дослідження in vitro та випробування на тваринах показали, що метформін зменшує ступінь тубулоінтерстиціального фіброзу та товщину епітеліальномезенхімального переходу, зупиняє розростання кіст на моделях полікістозу нирок та запобігає розвитку нефропатії, спричиненої гентаміцином, обструкцією сечоводу, ішемією-реперфузією та застосуванням стрептозотоцину/нікотинаміду [15]. Що стосується експериментальної діабетичної нефропатії, автори відзначили, що метформін запобігає опосередкованому глюкозою апоптозу людських подоцитів [16] та зменшує екскрецію альбуміну з сечею у щурів-діабетиків [17]. Наразі доклінічних відомостей значно більше, ніж клінічних. У ретроспективному когортному дослідженні у пацієнтів з трансплантованою ниркою було виявлено, що прийом метформіну пов’язаний з поліпшеною виживаністю алотрансплантатів та зниженням смертності [18]. Незважаючи на те що дослідження UKPDS не продемонструвало жодного очевидного впливу метформіну на ниркову смертність або частоту розвитку ниркової недостатності, було проведено окреме дослідження на пацієнтах з вперше діагностованим захворюванням, і загальна кількість досліджуваних явищ серед них була дуже низькою [1]. Навпаки, було встановлено, що метформін знижує ризик тяжкої ниркової недостатності, про що свідчив аналіз великої бази даних пацієнтів первинної ланки медичної допомоги у Великій Британії [19]. Більше того, порівняно із похідними сульфонілсечовинами, початок терапії метформіном був пов’язаний з меншим ризиком втрати функції нирок [20]. У нещодавно проведеному дослідженні у пацієнтів з ЦД 1-го типу (REMOVAL) не було зафіксовано випадків, коли розрахована швидкість клубочкової фільтрації (рШКФ) знижувалася до < 30 мл × хв-1 × 1,73 м2 [14]. У групі терапії метформіном рШКФ з часом залишалася більш стабільною, різниця між групами становила 4,0 мл × хв-1 × 1,73 м2 (2,19–5,81, Р <0,001) на користь метформіну протягом 3 років [14]. Серед пацієнтів з ЦД, у яких терапію метформіном скасували через дисфункцію нирок, повідомляли про погіршення глікемічного контролю, а також про більш раннє погіршення функції нирок [21]. Нещодавно було проведено велике (> 10 000 пацієнтів) ретроспективне обсерваційне когортне дослідження [22] з вивчення відомостей про пацієнтів з ЦД 2-го типу та ХХН у двох спеціалізованих корейських лікарнях. Навіть після застосування непараметричного методу відбору подібного за коефіцієнтом схильності, прийом метформіну і надалі пов’язувався із зниженим ризиком смертності від усіх причин та кінцевою стадією хвороби нирок, незалежно від показника рШКФ на початку терапії метформіном. Ця різниця була помітна навіть серед 208 пацієнтів з рШКФ <30 мл × хв-1 × 1,73 м2. Наразі триває дослідження під назвою «Метформін як ренопротектор від прогресуючої хвороби нирок» (Metformin as RenoProtector of Progressive Kidney Disease; RenoMet), що має завершитися у 2021 році; у дослідженні вивчають застосування метформіну в порівнянні з плацебо у хворих на ХХН без діабету. Результати цього дослідження дозволять пролити більше світла на реальний вплив метформіну на кардіоренальні наслідки лікування.
МЕТФОРМІН І ОНКОЛОГІЯ
Питання про наявність зв’язку між прийомом метформіну та зниженням захворюваності на онкологічні захворювання та смертності від них неодноразово поставало у літературі. Огляд епідеміологічних досліджень, а також нещодавно завершених та поточних клінічних досліджень, виконаний Heckman-Stoddard et al. [6] у 2017 році, свідчить про зменшення загальної захворюваності на рак та смертності від онкологічних захворювань на 10–40 % за висновками різних метааналізів. Це підтверджує дані, опубліковані в попередньому метааналізі тих самих авторів [23], у якому щодо фактичного зменшення ризику вони висловлювалися обережно. Так само висновки метааналізів дозволяють говорити про зниження смертності від раку серед осіб з раком товстої кишки, легенів та передміхурової залози та покращення виживаності за наявності інших неопластичних захворювань. Огляд, проведений Heckman-Stoddard et al. [6], також аналізує результати 17 проведених на сьогодні клінічних досліджень. Ці дослідження різнилися залученими учасниками, формами раку та стадією пухлинного процесу і не давали однозначних результатів. Тим не менш, інтерес до можливого сприятливого ефекту метформіну у пацієнтів з діабетом та без нього, які страждають на пухлинні захворювання, досі не полишає дослідників. У проведеному огляді автори Heckman-Stoddard et al. нарахували щонайменше 27 поточних досліджень, які на той момент були зареєстровані на сайті ClinicalTrials.gov. З того часу їхня кількість тільки збільшується, і наразі у вказаному регістрі зареєстровано більше 50 досліджень. Ці дослідження можуть не тільки додати відомостей на підтримку захисних ефектів метформіну, але й визначити, чи реагують якісь конкретні типи раку на метформін краще, ніж інші.
МЕТФОРМІН І КОГНІТИВНА ФУНКЦІЯ
Сьогодні когнітивна дисфункція вважається одним із багатьох ускладнень діабету [24]. На фоні ЦД 2-го типу існує підвищений ризик розвитку судинної деменції та хвороби Альцгеймера (ХА). Порушення сигнальних шляхів інсуліну, окислювальний стрес та хронічне запалення формують загальний фон для розвитку традиційних ускладнень діабету та нейродегенеративних захворювань. Нещодавно проведений метааналіз трьох досліджень показав, що поширеність когнітивних порушень у пацієнтів із ЦД 2-го типу, які отримували метформін, значно нижча (відношення ризиків 0,55; 95 % ДІ: 0,39–0,78), тоді як в іншій серії з шести досліджень повідомляли про значуще зменшення частоти випадків деменції (відношення ризиків 0,76; 95 % ДІ: 0,39– 0,88). В опитуванні, в якому взяла участь 67 731 особа, використання метформіну пов’язувалося із зменшенням ризику розвитку деменції у пацієнтів з діабетом. Цей ефект не залежав від глікемічного контролю і тривало зберігався порівняно з іншими глюкозознижуючими препаратами. Orkaby et al. [25] нещодавно опублікували роботу, у якій йдеться про те, що після коригування на такий спотворюючий чинник, як показання до застосування, метформін й надалі асоціювався з меншим ризиком подальшого розвитку деменції, ніж на тлі використання похідних сульфонілсечовини у ветеранів віком < 75 років. Проспективне обсерваційне Сіднейське дослідження пам’яті та старіння (Sydney Memory and Ageing Study), що було проведено за участі 1037 осіб без деменції у віці 70–90 років на вихідному рівні, які жили не в будинках для літніх людей, показало, що через 6 років у пацієнтів, які отримували метформін, спостерігалося значно повільніше зниження загальної когніції та виконавчої функції, подібне до того, що спостерігалося у пацієнтів без діабету. І навпаки, у пацієнтів з діабетом спостерігалося підвищене число випадків деменції (відношення шансів 5,29; 95% ДІ: 1,17–23,88, Р = 0,05) [26]. Зовсім нещодавно у пілотному дослідженні 20 пацієнтів без діабету з легкими когнітивними порушеннями або легкою деменцією через ХА були рандомізовані для отримання метформіну, а потім плацебо протягом 8 тижнів або навпаки. Метформін, за висновками, був пов’язаний із покращенням виконавчого функціонування, виявлена динаміка вказувала на покращення здатності до навчання/пам’яті та уваги [27]. Однак увагу привертає не лише потенційний терапевтичний ефект метформіну щодо ХА. Перебіг цілого ряду інших нейродегенеративних станів, як видається, потенційно може покращуватися на тлі застосування цього препарату, включаючи епілепсію [28]. В огляді, проведеному Markowicz-Piasecka et al. [29], автори вивчали результати кількох доклінічних досліджень, які кажуть на користь потенційного захисного ефекту метформіну щодо порушень когнітивної функції та можливих механізмів дії.
МОЖЛИВИЙ МЕХАНІЗМ(И) ПОЗИТИВНИХ ПЛЕЙОТРОПНИХ ЕФЕКТІВ МЕТФОРМІНУ
Як ми вже зазначали, механізм(и), за допомогою яких метформін чинить свої численні корисні ефекти, досі в значній мірі залишаються незрозумілими. Вчені, як правило, зосереджуються на активації протеїнкінази, яка активується аденозинмонофосфатом (АМФК) [30], основною функцією якої є підтримка енергетичного гомеостазу під час голодування. Глюкозознижувальні ефекти метформіну переважно зумовлені пригніченням печінкового глюконеогенезу. Як було показано, метформін у печінці інгібує дихальний ланцюг мітохондрій, що призводить до активації АМФК, покращуючи чутливість до інсуліну та зменшуючи рівень цАМФ з подальшим пригніченням експресії глюконеогенних ферментів [31]; з іншого боку, були описані також і незалежні від діяльності АМФК механізми [32]. Цікаво, що дією сигнального шляху АМФК/mTOR також пояснювали молекулярні механізми, що лежать в основі багатьох плейотропних ефектів метформіну.
У міокардіальних клітинах активація АМФК метформіном через інгібування ацетил-CoA-карбоксилази (АСС) зменшує синтез малоніл-КоА. Більше того, інгібуючий ефект АМФК на карнітин-пальмітоїлтрансферазу 1 (CPT1) посилює окислення жирних кислот [33] з одночасним збільшенням засвоєння глюкози [32] за рахунок збільшення транслокації GLUT4 та зменшення ендоцитозу [34]. АМФК вважається важливою мішенню у разі розвитку ендотеліальної дисфункції та атеросклерозу, наявні дослідження підтверджують сприятливий вплив активації АМФК на функцію ендотелію завдяки антиоксидантному ефекту в клітинах ендотелію [35]. Метформін може чинити численні корисні ефекти також і у пацієнтів із серцевою недостатністю через активацію шляхів АМФК/PGC1-α [36] та АМФК/еNO-синтази [37] та захист міокарда в умовах ішемії та ішемії-реперфузії [38]. Нарешті, було показано, що активація АМФК метформіном зменшує хронічне запалення міокарда, апоптоз кардіоміоцитів та аутофагію [39].
Нещодавно Ravindran et al. [5] у своїй роботі наголосили, що за сприятливі ниркові ефекти метформіну відповідає саме сигнальний шлях АМФК/mTOR. АМФК також сприяє аутофагії, зменшенню стресу ендоплазматичного ретикулума та пригніченню запалення та окислення, спричинених кінцевими продуктами глікації (КПГ). Переваги використання метформіну у разі наявності діабетичної нефропатії насправді можуть бути зумовлені зменшенням окислювального стресу, що його спричиняє АМФК [40]. Крім того, нещодавно з’явилася інформація про те, що метформін безпосередньо зв’язується з рекомбінантним доменом фосфатази SHIP2 та зменшує його каталітичну активність in vitro [41]. Як показали моделі діабету на тваринах, на тлі цього захворювання спостерігається підвищена експресія SHIP2, який пригнічує передачу сигнальних шляхів інсуліну, що призводить до інсулінорезистентності та пригнічення транспорту глюкози [41]. У якості молекулярного механізму, за допомогою якого терапія метформіном зменшує втрату подоцитів у пацієнтів з ЦД 2-го типу, було запропоновано вважати процес зниження активності SHIP2 [41].
Активація АМФК також вважається основним механізмом, яким пояснюється захисна дія метформіну щодо злоякісних утворень, оскільки він інгібує шлях mTOR, пригнічуючи проліферацію клітин, апоптоз та термінацію клітинного циклу неопластичної клітини [42]. Цей протипухлинний ефект, швидше за все, є результатом інсулінпригнічуючої активності, яка може зменшувати проліферацію в осіб з гіперінсулінемією, та пригнічення мітохондріального дихання та зменшення вмісту енергії в пухлинній клітині [43].
АМФК є важливим метаболічним датчиком у центральній нервовій системі [44], існують відомості про зниження її рівнів у пацієнтів з нейродегенеративними патологіями [45]. Саме тому нейропротекторний ефект метформіну пояснюють його відомим впливом на активацію АМФК [28].
Широка активація АМФК, індукована метформіном, дуже точно мімікрує під дисбаланс між постачанням енергії та споживанням енергії, що виникає у відповідь на голодування та фізичні вправи. Як і метформін, інгібітори натрійзалежного котранспортеру глюкози 2 типу (іНЗГТГ-2) імітують умови голодування [46], викликаючи таким чином підвищення регуляції АМФК, та, ймовірно, активацію інших факторів, що зменшують клітинний стрес (наприклад, сиртуїна-1 та факторів, що індукують гіпоксію [47]), навіть незважаючи на те, що іНЗГТГ-2 та метформін по-різному впливають на глюконеогенез. Як правило, голодування або фізичне навантаження спричиняють збільшення масштабів застосування альтернативних субстратів енергії, таких як лактат та β-гідроксибутират. Що ж стосується іНЗГТГ-2, Ferrannini et al. [48] висловили гіпотезу, що саме перехід на кетони як енергетичний субстрат є однією з причин зменшення випадків серцево-судинних ускладнень, що спостерігаються на тлі застосування іНЗГТГ-2. Під час проведення терапії іНЗГТГ-2 концентрація кетонів, як правило, коливається від 0,1 ммоль/л до 0,5 ммоль/л [49], хоча за певних стресових умов кетогенез може активуватися до рівня еуглікемічного кетоацидозу. І хоча метаболізм кетонів на тлі терапії іНЗГТГ-2 ніколи не вимірювався, концентрація кетонів, як видається, є занадто низькою, щоб кількісно являти собою фактичну альтернативу глюкозі у якості енергетичного субстрату.
На тлі лікування метформіном збільшується концентрація лактату [50], і, на відміну від кетонів, концентрація лактату (≈ 1,0 ммоль/л) є кількісно достатньою для функціонування в якості альтернативного субстрату. Принципова перевага використання лактату в серці, головному мозку та нирках полягає в тому, що він може безпосередньо поглинатися та окислюватися (рис. 1) [51]. І тут ми припускаємо, що захисний ефект метформіну на ССС, нирки та головний мозок, а також його протипухлинна дія принаймні частково можуть опосередковуватися підвищеною доступністю лактату.
Таблиця 1. Основні молекулярні механізми дії метформіну
| Активація АМФК [29] |
| Інгібування комплексу 1 мітохондріального дихального ланцюга [31] |
| Підвищення АДФ/АТФ та AMФ/АТФ [31] |
| Зниження транскрипційного фактору NF-κ [31] |
| Інгібування STAT3 [31] |
| Інгібування ацетил-CoA-карбоксилази [АСС] |
| Інгібування CPT1 [32] |
| Інгібування SHIP2 [41] |
| Інгібування сигнального шляху mTOR [5] |
| Активація сигнального шляху АМФК/PGC1-α [36] |
| Активація сигнального шляху АМФК/еNO-синтази [36] |
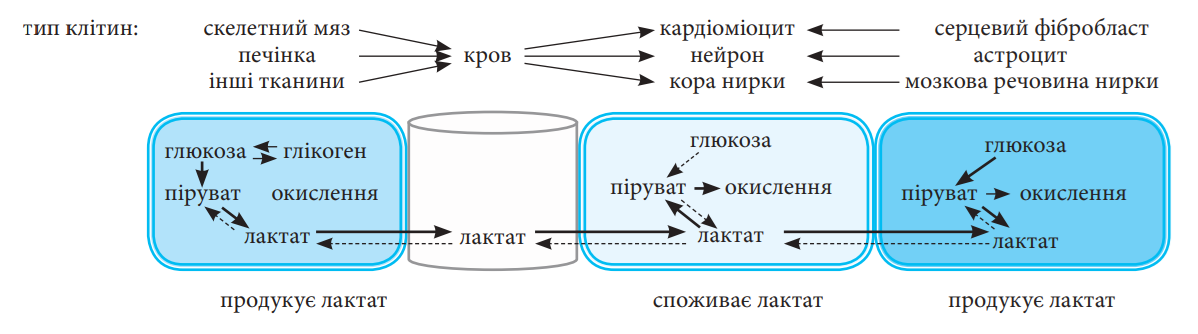
Рис. 1. Лактатний «човник», який просувається завдяки метформіну. Метформін сприяє продукції лактату практично будь-якою тканиною та клітиною, що містять глікоген та (або) поглинають глюкозу — як дистальними (включаючи кишківник, печінку та м’язи), так і проксимальними (наприклад, серцеві фібробласти, астроцити або клітини мозкові речовини нирки). Далі кардіоміоцити, нейрони або ниркові клітини можуть поглинати лактат і безпосередньо окислювати його для негайного використання, минаючи гліколіз.
МОЛОЧНА КИСЛОТА ЯК МЕДІАТОР ПЛЕЙОТРОПНИХ ЕФЕКТІВ МЕТФОРМІНУ
Глюкоза виробляється головним чином в печінці (і до певної міри — в нирках), тоді як усі інші тканини та клітини лише поглинають глюкозу. А лактат, навпаки, може вироблятися та виділятися практично будь-якою тканиною та клітиною, що містить глікоген та (або) поглинає глюкозу, хоча за надлишок лактату, що досягає кровообігу, судячи з усього, відповідає стінка кишківника, [52], і швидше за все через дуже високу локальну концентрацію препарату. Додатковий лактат, що виділяється кишківником, переважно надходить у печінку через ворітну вену, де частково перетворюється на глюкозу, що збільшує оборот глюкози після прийому метформіну [53]. З цієї точки зору цікаво зазначити, як у досить новій роботі було показано, що метформін збільшує ендогенну продукцію глюкози та утилізацію глюкози як в осіб із нещодавно встановленим ЦД 2-го типу, так і в контрольних осіб без діабету [54]. Чи збільшує метформін базальну швидкість зникнення глюкози шляхом сприяння засвоєнню глюкози в інших тканинах, таких як кишківник, не зовсім зрозуміло, це питання ще треба докладно вивчати. Проте ця точка зору цілком вписується у блок циклу Корі, запропонований Bailey et al. [52] — це ефект, який, судячи з усього, стає особливо очевидним після прийому їжі, що призводить до перерозподілу енергетичного субстрату. Лактат може поглинатися усіма тканинами і безпосередньо окислюватися задля подальшого негайного використання [51]. Окрім осі енергетичного гомеостазу «кишківник – печінка – м’язи», лактат являє собою головний «міжклітинний човник» та «внутрішньоклітинний човник», необхідний для доставки окислювальних та глюконеогенних субстратів, він також є головним гравцем у системі клітинних сигналів [55, 56]. Міжклітинні лактатні «човники» виконують обмін лактатом між білими гліколітичними м’язами та червоними окислювальними м’язовими волокнами всередині працюючих м’язів, але й також (рис. 1) між скелетними м’язами та серцем [57], головним мозком [58], печінкою та нирками [59], астроцитами й нейронами і нейронами та астроцитами [60]. Підсумовуючи, зазначимо, що молочна кислота, як нещодавно було описано, більше не може вважатися лишень кінцевим продуктом гліколізу [61]. Це стає ще більш очевидним, якщо пам’ятати, що лактат активно транспортується через плазматичні мембрани за допомогою монокарбоксилатних транспортерів і є активним лігандом рецептору, пов’язаного з білком G1 (GPR81), який експресується в багатьох органах і тканинах, включаючи жирову тканину, скелетну мускулатуру [62], печінку, нирки та головний мозок [63]. Таким чином, лактат можна вважати альтернативним субстратом практично в усіх тканинах, який стає надзвичайно важливим для органів, пошкоджених діабетом.
У нормі у спокої міокард постійно вивільняє і поглинає лактат, ці процеси значно посилюються під час стимуляції передсердь [57]. Більше того, лактат, тією ж мірою, що й глюкоза, відіграє свою роль у підтримці роботи міокарда [57]. Серце пацієнта з діабетом має знижену здатність до утилізації глюкози, особливо у моменти ішемії. Цей недолік може бути частково компенсований гіперглікемією [64]. Оскільки кардіоміоцити використовують лактат у першочерговому порядку, підвищення рівня лактату, що його спричиняє метформін, може забезпечити організму альтернативний енергетичний субстрат. Зовсім нещодавно було висловлене припущення, що «човник», який «курсує» від фібробластів до кардіоміоцитів, може функціонувати в серці [65]. В межах дії цього міжклітинного «човника», глюкоза поглинається фібробластами, які виділяють лактат, що має використатися кардіоміоцитами (рис. 1). Автори згаданої роботи натякають на те, що у тварин з інсулінорезистентністю ця метаболічна «перекличка» порушується, і підкреслюють необхідність враховувати цей механізм при розробці стратегій лікування серцевої недостатності та захворювань серця, пов’язаних з діабетом. Зважаючи на це, так і проситься висловити гіпотезу, що метформін, покращуючи дію інсуліну на фібробласти міокарда, може відновити «курсування» лактатного «човника» між клітинами, впливаючи тим самим на захист серцево-судинної системи. Нові експериментальні дані показали, що активація GPR81 за рахунок фізіологічно підвищених концентрацій лактату може врятувати окислювальний стрес і зменшити рівень запальних цитокінів у клітині ендотелію [66], що таким чином підтверджує його потенційну антиатеросклеротичну дію.
Лактат є основним субстратом для нирок. Частково використовується для глюконеогенезу, але здебільшого як легкодоступний субстрат для забезпечення високих енергетичних потреб ниркової функції [67]. На тлі ЦД 2-го типу нирковий гліколіз посилюється і вочевидь від’єднується від мітохондріального дихання. Якщо мітохондріального дихання достатньо для споживання пірувату, що виробляється, та для підтримання збиткового відділення гліколітиків, посилений збитковий відтік гліколітиків може запобігти накопиченню токсичних метаболітів глюкози, що виникають в умовах гіперглікемії (наприклад, поліолів). Qi et al. [68] провели протеомічний аналіз на ниркових клубочках пацієнтів з нефропатією та без неї, які страждали на діабет понад 50 років. У пацієнтів без нефропатії відзначався високий рівень ферментів, що беруть участь у регуляції гліколізу та мітохондріальному диханні; зокрема підвищений рівень піруваткінази М2 був визначений у якості захисного фактору у протидії розвитку нефропатії. Якщо мітохондріальна функція порушується, посилений гліколіз може призвести до накопичення гліколітичних проміжних продуктів, які рясно виділяються у поліольний шлях, де вони переробляються на фруктозу [69]. Далі фруктоза фосфорилюється фруктокіназою, що призводить до утворення сечової кислоти та КПГ, і це — одна з відмінних рис ураження нирок при діабеті. Sas et al. [70] виявили, що сечові маркери посиленого ниркового гліколізу в поєднанні з наявністю змінених мітохондріальних білків можуть бути провісниками нефропатії у пацієнтів з діабетом. Оскільки лактат поглинається безпосередньо з кровообігу без гліколізу в нирках (рис. 1), гліколітичні метаболіти не утворюються, а поглинається лишень та кількість лактату, яка може окислитися. Патофізіологічне значення цієї системи рясного виділення гліколітиків при пошкодженні та відновленні нирок було додатково проілюстровано дослідженням від Andres-Hernando et al. [71], які показали, що гаплонедостатність фруктокінази захищає мишей від ішемічного ушкодження нирок. Миші з дефіцитом фруктокінази мали знижений рівень виснаження АТФ, більш низький рівень сечової кислоти в нирках, нижчий рівень маркерів окислювального стресу та менший ступінь пошкодження нирок порівняно з мишами дикого типу з ішемічним ушкодженням нирок [71]. Отже, лактат — це паливо, яке повністю згоряє (порівняно з глюкозою), що забезпечує нирки енергією та захищає їх від накопичення відходів (КПГ).
Лактат також є ключовим енергетичним субстратом у центральній нервовій системі [72]. Maran et al. [73] показали, що лактат є альтернативним та ідеальним субстратом для головного мозку в умовах гіпоглікемії, і зростаючий масив даних у літературі каже на підтримку його захисної дії на тканини мозку [74]. У головному мозку астроцити забирають більшу частину глюкози, що постачається, і метаболізують її до лактату, який активно транспортується до нейронів, де він може потрапити в окислювальний шлях (рис. 1), виконувати сигнальні функції [72] та активувати гени, пов’язані з формуванням довготривалої пам’яті [75]. Отже, спричинена лактатом активація GPR81 може відігравати вирішальну роль у навчанні та формуванні пам’яті. Як такий, лактат також може зменшити втрату пам’яті та когнітивні порушення. Ці ефекти в поєднанні з підвищеною продукцією протизапальних цитокінів та зменшенням запальних [76] можуть пояснювати нейропротекторні ефекти від підвищеної концентрації лактату, які спостерігаються на тлі застосування метформіну. Спокусливо припустити, що такі ж самі механізми можуть мати місце у ділянках сітківки. Встановлено, що у внутрішніх клітинах сітківки лактат виконує захисну функцію проти екзитотоксичності глутамату та нейрозапалення та регулює клітинний об’єм та метаболізм [77]. Лактат, зокрема, продемонстрував свій позитивний ефект у сприянні функціонуванню та виживанню клітин Мюллера [78].
Хоча лактат, як вже було вказано, може мати сприятливий вплив на серце, нирки та головний мозок, його роль у протипухлинному ефекті метформіну може бути не такою простою. Через високий рівень гліколізу, притаманний неопластичній клітині, спостерігається рясна продукція лактату, який сприяє ацидозу у мікросередовищі пухлини. Вважається, що підвищена доступність лактату на місцевому рівні сприяє пухлинному росту шляхом втручання у запальну реакцію та функції макрофагів, а також сприяння ангіогенезові [61]. Метформін може чинити протипухлинну дію через непрямі (інсулінозалежні) та прямі (інсулінонезалежні) механізми, а також через порушення гліколітичної активності та цикл трикарбонових кислот [79]. Метаболомічні дослідження показали, що незважаючи на стимулювання споживання глюкози та продукції лактату, метформін в кінцевому рахунку знижує кількість специфічних проміжних продуктів гліколізу, а також рівні майже всіх проміжних сполук у циклі трикарбонових кислот [80]. Таким чином, хоча посилена продукція лактату, спричинена метформіном, може не мати прямого ефекту, тим не менш, вона є маркером протипухлинної дії препарату.
Підводячи підсумок, зазначимо, що фізіологічно висока концентрація молочної кислоти та активація міжклітинного лактатного «човника», що спостерігається у разі застосування метформіну, можуть відігравати свою роль у багатьох сприятливих ефектах цього препарату; однак підвищення концентрації лактату зазвичай вважається провісником лактоацидозу.
МЕТФОРМІН ТА ЛАКТОАЦИДОЗ
Концентрації лактату в крові, як правило, стабільні, оскільки його продукція та споживання є рівноцінними [51]. Як вже згадувалося, одним з основних ефектів метформіну є збільшення продукції лактату [50], головним чином через стінку кишківника. Оскільки в нормі кліренс лактату пропорційний його концентрації, збільшення кількості лактату під час лікування метформіном зазвичай є мінімальним [50]. Таким чином, тяжка гіперлактатемія виникає головним чином у разі зменшення кліренсу, що призводить до лактоацидозу. Лактоацидоз, що виникає під час лікування метформіном (метформін-асоційований лактоацидоз, або МАЛА), класифікується як тип В, оскільки він розвивається у разі порушення кліренсу молочної кислоти через окислення або глюконеогенез, хоча може мати ознаки типу А, а тому гіпоксемію слід вважати протипоказанням до застосування препарату.
Метформін не метаболізується і виводиться у незмінному вигляді переважно нирками [81]. А оскільки кліренс метформіну залежить лише від функції нирок, у разі тяжкого зниження ступеня ниркової фільтрації, препарат накопичується у плазмі крові. Фактичний рівень концентрації метформіну в плазмі, при якому підвищується ризик розвитку МАЛА, залишається предметом дискусій. За умови дотримання рекомендованої дози та графіків застосування концентрації метформіну зазвичай становлять < 1 мг/л і лише зрідка перевищують 5 мг/л; тільки стійкий рівень концентрації вище цього значення, схоже, збільшує ризик розвитку МАЛА [81]. У зовсім новій роботі автори показали, що у пацієнтів, які були госпіталізовані «швидкою допомогою», концентрація метформіну в плазмі крові ≥ 9,9 мг/л дуже чітко пов’язувалася з наявністю лактоацидозу [82].
Однак МАЛА — надзвичайно рідкісне явище, її поширеність оцінюється на рівні 7,4 випадків на 100 000 людино-років [83]; тож частота подій є дуже низькою, більше того, вона базується переважно на повідомленнях про клінічні випадки [84]. Повідомлення такого типу зрідка містять адекватну інформацію про клінічний контекст, дози, супутні патології чи інші клінічні явища [15]. У нещодавно опублікованому дослідженні, проведеному Lalau з колегами [15], автори вивчали різні режими дозування метформіну при помірному та тяжкому перебігу ХХН [стадії 3A/3B та 4, відповідно) з точки зору безпеки та ефективності. Рівні метформіну у плазмі крові у більшості пацієнтів стабільно залишались нижче 2,5 мг/л. Як вже зазначалося вище, у великому когортному дослідженні [22] не було виявлено збільшення частоти МАЛА на тлі застосування метформіну, навіть у пацієнтів із рШКФ < 30 мл × хв-1 × 1,73 м2.
Проте, незважаючи на низький рівень поширеності МАЛА, органи охорони здоров’я та медичні спільноти постійно наголошують на наявності небезпеки застосування препарату у пацієнтів з групи ризику. Ряд національних органів охорони здоров’я та діабетологічних асоціацій рекомендують розпочинати застосування метформіну у пацієнтів із рШКФ > 45 мл × хв-1 × 1,73 м2 і продовжувати терапію з високою обережністю та за умови зниження дози, якщо рШКФ зменшується до 30 – < 45 мл× хв-1 × 1,73 м2 [85], ті самі спостереження повідомлялися у кількох клінічних дослідженнях [86]. Застосування менших доз метформіну — на рівні 500/1000 мг на добу — буде безпечним навіть у пацієнтів з тяжкою нирковою недостатністю [84]; пацієнтам слід рекомендувати дотримуватися «правил лікарняних днів» у разі гострого та тяжкого перебігу хвороби. Більше того, на сьогоднішній день жодне дослідження дозозалежного ефекту не продемонструвало виникнення серйозних побічних реакцій для визначеної дози або рШКФ, а поточні рекомендації щодо рівнів дози побудовані на оцінках, продиктованих з великою обережністю. Отже, питання про зв’язок між застосуванням метформіну та розвитком лактоацидозу остаточно ще далеко не вирішено, але, враховуючи широке використання препарату, МАЛА все ж залишається рідкісним явищем. Bennis et al. [82] нещодавно публікували відомості про зв’язок між концентрацією метформіну в плазмі крові, лактоацидозом та смертністю серед 194 пацієнтів із діабетом, яких послідовно госпіталізували у відділення інтенсивної терапії (ВІТ). У 87 пацієнтів (44,8 %) було діагностовано лактоацидоз (тобто рН артеріальної крові становив < 7,35, концентрація лактату ≥ 4 ммоль/л), 38 з них (43,7 %) померли у ВІТ. Концентрацію метформіну ≥ 9,9 мг/л зі статистичною значущістю пов’язували з лактоацидозом, але така концентрація метформіну також була пов’язана з меншою кількістю смертей у ВІТ, через що зв’язок між рівнем метформіну, концентрацією лактату та смертністю була менш чіткою. Переваги застосування метформіну у пацієнтів із ХХН значно перевищують його потенційні ризики. З огляду на це, враховуючи переваги метформіну щодо підтримки належного контролю рівня глюкози та уповільнення погіршення функції нирок, МАЛА слід розглядати як протипоказання, яке піддається правильному веденню завдяки ретельному контролю дозування та захворювань у пацієнтів з ХХН. Лікарі, що призначають терапію, та пацієнти з ХХН, які отримують метформін, повинні бути навчені тимчасово призупиняти метформін у разі тяжкого загострення захворювання, особливо у разі гострої ниркової недостатності, оскільки за цих обставин рівень лактату помітно зростає [87].
ВИСНОВКИ
Метформін застосовується у клінічній практиці вже понад 60 років і досі залишається препаратом першого вибору при ЦД 2-го типу. Від появи самих перших гіпотез про те, що метформін може забезпечувати захист для ССС, за ці роки були накопичені додаткові дані, які свідчать не лише про те, що препарат можна більш вільно застосовувати безвідносно функції нирок, але й про те, що він може сприяти нефропротекції. Наявні відомості також вказують на те, що метформін може зменшувати ризик нейродегенеративних захворювань, наразі тривають клінічні дослідження щодо безпосередньої оцінки протипухлинних властивостей препарату. Тим не менш, незважаючи на великий і багаторічний досвід клінічного застосування препарату, механізм його дії досі до кінця не з’ясований, а захисна дія, яку він може чинити на ССС, нирки, головний мозок, так само, як і його протипухлинний ефект, вочевидь значною мірою не залежать від його глюкозознижувальної ефективності. Молекулярні механізми дії метформіну, головним чином, включають активацію шляху АМФК/ mTOR, що значною мірою кореспондується з тим, що відбувається у фізіологічних умовах обмеженої наявності енергії. Ці ефекти можна вважати такими, які певною мірою подібні до ефектів, що їх спричиняють іНЗГТГ-2 — інший клас глюкозознижувальних препаратів із доведеною кардіоренальною протекцією. Метаболічні ефекти метформіну та іНЗГТГ-2 дійсно можуть у чомусь мати подібність. Наприклад, використання іНЗГТГ-2 призводить до помірного збільшення плазмової концентрації кетонових тіл, які вважаються альтернативним енергетичним субстратом, що, як стверджується сьогодні, відіграє свою роль у позитивних ефектах цих препаратів щодо захисту ССС. Цікаво, що прийом метформіну також супроводжується підвищенням рівня в крові іншого альтернативного «паливного» субстрату — молочної кислоти. Крім того, існують докази щодо вирішальної ролі міжклітинного лактатного «човника», а сам лактат є активним лігандом для специфічних рецепторів, завдяки яким може відбуватися регуляція енергії в клітинах, протизапальна відповідь, імунна толерантність, антифібротична дія, генетична пластичність тощо [88]. Аналогія між іНЗГТГ-2 та метформіном стає ще більш робочою, якщо врахувати потенційний ризик накопичення альтернативного субстрату, що може призвести до розвитку небажаної тяжкої реакції. У випадку з іНЗГТГ-2 стресові умови та відносно низька доступність інсуліну можуть спричинити надмірну активацію кетогенезу з розвитком еуглікемічного кетоацидозу [89]. Що ж до метформіну, гіпоксемія може призвести до збиткового відновлення пірувату до лактату з розвитком лактоацидозу [84]. Що цікаво, існують майже однакові рекомендації щодо зменшення ризику розвитку цих загрозливих станів для обох препаратів [87]. У підсумку, ми висловлюємо припущення, що належне застосування цих препаратів забезпечує переваги для пацієнтів, принаймні частково — завдяки фізіологічному збільшенню активних субстратів: кетонів — якщо йдеться про іНЗГТГ-2, і, можливо, лактату — у разі метформіну. Ця гіпотеза, вочевидь, потребуватиме спеціальних досліджень, спрямованих на пошук відповіді на питання, чи може активація лактатного «човника», поряд з підвищенням рівнів циркулюючого лактату, дійсно бути тим самим потенційним механізмом, за рахунок якого виникають численні ефекти, які, як вважається, чинить метформін.
Вперше опубліковано:Andrea Giaccari, Anna Solini, Simona Frontoni, Stefano Del Prato. Metformin Benefits: Another Example for Alternative Energy Substrate Mechanism? Diabetes Care 2021;44:647–654 | https://doi. org/10.2337/dc20-1964.
Ліература
- UK Prospective Diabetes Study (UKPDS) Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998;352:854–865
- Buse JB, Wexler DJ, Tsapas A, et 2019 update to: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2020;63:221–228
- Garber AJ, Handelsman Y, Grunberger G, et Consensus statement by the American Association of Clinical Endocrinologists and American College of Endocrinology on the comprehensive type 2 diabetes management algorithm 2020 executive summary. Endocr Pract 2020;26:107–139
- Rajasurya V, Anjum H, Surani Metformin use and metformin-associated lactic acidosis in intensive care unit patients with diabetes. Cureus 2019;11:e4739
- Ravindran S, Kuruvilla V, Wilbur K, Munusamy Nephroprotective effects of metformin in diabetic nephropathy. J Cell Physiol 2017;232: 731–742
- Heckman-Stoddard BM, DeCensi A, Sahasrabuddhe VV, Ford Repurposing metformin for the prevention of cancer and cancer recurrence. Diabetologia 2017;60:1639–1647
- Zhang Q-Q, Li W-S, Liu Z, Zhang H-L, Ba Y-G, Zhang R-X. Metformin therapy and cognitive dysfunction in patients with type 2 diabetes: a meta-analysis and systematic Medicine (Baltimore) 2020;99:e19378
- Reitz KM, Marroquin OC, Zenati MS, et Association between preoperative metformin exposure and postoperative outcomes in adults with type 2 diabetes. JAMA Surg 2020;155:e200416
- Scheen Metformin and COVID-19: from cellular mechanisms to reduced mortality. Diabetes Metab 2020;46:423–426
- Holman RR, Paul SK, Bethel MA, Matthews DR, Neil 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008;359:1577–1589
- Kooy A, de Jager J, Lehert P, et Long-term effects of metformin on metabolism and microvascular and macrovascular disease in patients with type 2 diabetes mellitus. Arch Intern Med 2009;169:616–625
- Han Y, Xie H, Liu Y, Gao P, Yang X, Shen Effect of metformin on all-cause and cardiovascular mortality in patients with coronary artery diseases: a systematic review and an updated meta-analysis. Cardiovasc Diabetol 2019;18:96
- Zilov AV, Abdelaziz SI, AlShammary A, et Mechanisms of action of metformin with special reference to cardiovascular protection. Diabetes Metab Res Rev 2019;35:e3173
- Petrie JR, Chaturvedi N, Ford I, et ; REMOVAL Study Group. Cardiovascular and metabolic effects of metformin in patients with type 1 diabetes (REMOVAL): a double-blind, randomised, placebo-controlled trial. Lancet Diabetes Endocrinol 2017;5:597–609
- De Broe ME, Kajbaf F, Lalau J-D. Renoprotective effects of Nephron 2018;138: 261–274
- Langer S, Kreutz R, Eisenreich A Metformin modulates apoptosis and cell signaling of human podocytes under high glucose J Nephrol 2016;29:765–773
- ZhaiL,GuJ,YangD,HuW,WangW,YeS. Metformin ameliorates podocyte damage by restoring renal tissue nephrin expression in type 2 diabetic J Diabetes 2017;9:510–517
- Stephen J, Anderson-Haag TL, Gustafson S, Snyder JJ, Kasiske BL, Israni Metformin use in kidney transplant recipients in the United States: an observational study. Am J Nephrol 2014;40: 546–553
- Hippisley-Cox J, Coupland Diabetes treatments and risk of amputation, blindness, severe kidney failure, hyperglycaemia, and hypoglycaemia: open cohort study in primary care. BMJ 2016;352:i1450
- Hung AM, Roumie CL, Greevy RA, et Kidney function decline in metformin versus sulfonylurea initiators: assessment of timedependent contribution of weight, blood pressure, and glycemic control. Pharmacoepidemiol Drug Saf 2013;22:623–631
- Panossian Z, Drury PL, Cundy Reversible severe deterioration of glycaemic control after withdrawal of metformin treatment. Diabetologia 2012;55:267–269
- Kwon S, Kim YC, Park JY, et The long-term effects of metformin on patients with type 2 diabetic kidney disease. Diabetes Care 2020;43:948–955
- Gandini S, Puntoni M, Heckman-Stoddard BM, et Metformin and cancer risk and mortality: a systematic review and meta-analysis taking into account biases and confounders. Cancer Prev Res (Phila) 2014;7:867–885
- Simó R,Ciudin A,Simó-ServatO,Hernández C. Cognitive impairment and dementia: a new emerging complication of type 2 diabetes-the diabetologist’s Acta Diabetol 2017; 54:417–424
- Orkaby AR, Cho K, Cormack J, Gagnon DR, Driver Metformin vs sulfonylurea use and risk of dementia in US veterans aged $65 years with diabetes. Neurology 2017;89:1877–1885
- Samaras K, Makkar S, Crawford JD, et Metformin use is associated with slowed cognitive decline and reduced incident dementia in older adults with type 2 diabetes: the Sydney Memory and Ageing Study. Diabetes Care 2020; 43:2691–2701
- Koenig AM, Mechanic-Hamilton D, Xie SX, et Effects of the insulin sensitizer metformin in Alzheimer disease: pilot data from a randomized placebo-controlled crossover study. Alzheimer Dis Assoc Disord 2017;31:107–113
- HS Nandini, Paudel YN, Krishna Envisioning the neuroprotective effect of metformin in experimental epilepsy: a portrait of molecular crosstalk. Life Sci 2019;233:116686
- Markowicz-Piasecka M, Sikora J, Szydłowska A, Skupień A, Mikiciuk-Olasik E, Huttunen KM. Metformin: a future therapy for neurodegenerative diseases: theme: drug discovery, development and delivery in Alzheimer’s disease guest editor: Davide Pharm Res 2017;34: 2614–2627
- Zhou G, Myers R, Li Y, et Role of AMPactivated protein kinase in mechanism of metformin action. J Clin Invest 2001;108:1167–1174
- Rena G, Hardie DG, Pearson The mechanisms of action of metformin. Diabetologia 2017;60:1577–1585
- Foretz M, Guigas B, Viollet Understanding the glucoregulatory mechanisms of metformin in type 2 diabetes mellitus. Nat Rev Endocrinol 2019;15:569–589
- Ruderman NB, Park H, Kaushik VK, et AMPK as a metabolic switch in rat muscle, liver and adipose tissue after exercise. Acta Physiol Scand 2003;178:435–442
- Zhang L, He H, Balschi Metformin and phenformin activate AMP-activated protein kinase in the heart by increasing cytosolic AMP concentration. Am J Physiol Heart Circ Physiol 2007;293:H457–H466
- Sambe T, Mason RP, Dawoud H, Bhatt DL, Malinski Metformin treatment decreases nitroxidative stress, restores nitric oxide bioavailability and endothelial function beyond glucose control. Biomed Pharmacother 2018;98:149–156
- Gundewar S, Calvert JW, Jha S, et Activation of AMP-activated protein kinase by metformin improves left ventricular function and survival in heart failure. Circ Res 2009;104:403– 411
- Wang X-F, Zhang J-Y, Li L, Zhao X-Y, Tao H-L, Zhang Metformin improves cardiac function in rats via activation of AMP-activated protein kinase. Clin Exp Pharmacol Physiol 2011;38: 94–101
- Ye Y, Perez-Polo JR, Aguilar D, Birnbaum The potential effects of anti-diabetic medications on myocardial ischemiareperfusion injury. Basic Res Cardiol 2011;106:925–952
- Lu Q, Li X, Liu J, et AMPK is associated with the beneficial effects of antidiabetic agents on cardiovascular diseases. Biosci Rep 2019;39: BSR20181995
- RenH,ShaoY,WuC,MaX,LvC,WangQ. Metformin alleviates oxidative stress and enhances autophagy in diabetic kidney disease via AMPK/SIRT1-FoxO1 Mol Cell Endocrinol 2020;500:110628
- Polianskyte-Prause Z, Tolvanen TA, Lindfors S, et Metformin increases glucose uptake and acts renoprotectively by reducing SHIP2 activity. FASEB J 2019;33:2858–2869
- Han G, Gong H, Wang Y, Guo S, Liu AMPK/ mTOR-mediated inhibition of survivin partly contributes to metformininduced apoptosis in human gastric cancer cell. Cancer Biol Ther 2015; 16:77–87
- Pollak Investigating metformin for cancer prevention and treatment: the end of the beginning. Cancer Discov 2012;2:778–790
- Kemp BE, Mitchelhill KI, Stapleton D, Michell BJ, Chen Z-P, Witters Dealing with energy demand: the AMP-activated protein kinase. Trends Biochem Sci 1999;24:22–25
- Yang Y, Zhu B, Zheng F, et Chronic metformin treatment facilitates seizure termination. Biochem Biophys Res Commun 2017;484:450–455
- Giaccari A. Sodium-glucose co-transporter inhibitors: medications that mimic fasting for cardiovascular prevention. Diabetes Obes Metab 2019;21:2211–2218
- Wang S-Y, Cai G-Y, Chen X-M. Energy restriction in renal protection. Br J Nutr 2018;120: 1149–1158
- Ferrannini E, Mark M, Mayoux CV protection in the EMPA-REG OUTCOME trial: a “thrifty substrate” hypothesis. Diabetes Care 2016;39: 1108–1114
- Ferrannini E, Baldi S, Frascerra S, et Shift to fatty substrate utilization in response to sodium-glucose cotransporter 2 inhibition in subjects without diabetes and patients with type 2 diabetes. Diabetes 2016;65:1190–1195
- Davis TME, Jackson D, Davis WA, Bruce DG, Chubb The relationship between metformin therapy and the fasting plasma lactate in type 2 diabetes: the Fremantle Diabetes Study. Br J Clin Pharmacol 2001;52:137–144
- van Hall Lactate kinetics in human tissues at rest and during exercise. Acta Physiol (Oxf) 2010;199:499–508
- Bailey CJ, Wilcock C, Scarpello Metformin and the intestine. Diabetologia 2008;51:1552–1553 53. Bailey CJ, Wilcock C, Day C. Effect of metformin on glucose metabolism in the splanchnic bed. Br J Pharmacol 1992;105:1009–1013
- Gormsen LC, Søndergaard E, Christensen NL, Brøsen K, Jessen N, Nielsen Metformin increases endogenous glucose production in non-diabetic individuals and individuals with recent-onset type 2 diabetes. Diabetologia 2019;62:1251–1256
- Brooks Cell-cell and intracellular lactate shuttles. J Physiol 2009;587:5591–5600
- Brooks Lactate shuttles in nature. Biochem Soc Trans 2002;30:258–264
- Bergman BC, Tsvetkova T, Lowes B, Wolfel Myocardial glucose and lactate metabolism during rest and atrial pacing in humans. J Physiol 2009;587:2087–2099
- Glenn TC, Martin NA, Horning MA, et Lactate: brain fuel in human traumatic brain injury: a comparison with normal healthy control subjects. J Neurotrauma 2015;32:820–832
- Bergman BC, Horning MA, Casazza GA, Wolfel EE, Butterfield GE, Brooks Endurance training increases gluconeogenesis during rest and exercise in men. Am J Physiol Endocrinol Metab 2000;278:E244–E251
- Pellerin L, Pellegri G, Bittar PG, et Evidence supporting the existence of an activity-dependent astrocyte-neuron lactate shuttle. Dev Neurosci 1998;20:291–299
- Certo M, Marone G, de Paulis A, Mauro C, Pucino Lactate: fueling the fire starter. Wiley Interdiscip Rev Syst Biol Med 2020;12:e1474
- Kuei C, Yu J, Zhu J, et Study of GPR81, the lactate receptor, from distant species identifies residues and motifs critical for GPR81 functions. Mol Pharmacol 2011;80:848–858
- Lauritzen KH, Morland C, Puchades M, et Lactate receptor sites link neurotransmission, neurovascular coupling, and brain energy metabolism. Cereb Cortex 2014;24:2784–2795
- Stanley Rationale for a metabolic approach in diabetic coronary patients. Coron Artery Dis 2005;16(Suppl. 1):S11–S15
- Gizak A, McCubrey JA, Rakus Cell-to-cell lactate shuttle operates in heart and is important in age-related heart failure. Aging (Albany NY) 2020;12:3388–3406
- SunZ,HanY,SongS,ChenT,HanY,LiuY. Activation of GPR81 by lactate inhibits oscillatory shear stress-induced endothelial inflammation by activating the expression of IUBMB Life 2019;71:2010–2019
- Cohen JJ, Little Lactate metabolism in the isolated perfused rat kidney: relations to renal function and gluconeogenesis. J Physiol 1976; 255:399–414
- Qi W, Keenan HA, Li Q, et Pyruvate kinase M2 activation may protect against the progression of diabetic glomerular pathology and mitochondrial dysfunction. Nat Med 2017;23:753– 762
- Gugliucci Formation of fructose-mediated advanced glycation end products and their roles in metabolic and inflammatory diseases. Adv Nutr 2017;8:54–62
- Sas KM, Kayampilly P, Byun J, et Tissuespecific metabolic reprogramming drives nutrient flux in diabetic complications. JCI Insight 2016;1:e86976
- Andres-Hernando A, Li N, Cicerchi C, et Protective role of fructokinase blockade in the pathogenesis of acute kidney injury in mice. Nat Commun 2017;8:14181
- Barros Metabolic signaling by lactate in the brain. Trends Neurosci 2013;36:396–404 73. Maran A, Crepaldi C, Trupiani S, et al. Brain function rescue effect of lactate following hypoglycaemia is not an adaptation process in both normal and type I diabetic subjects. Diabetologia 2000;43:733–741
- Maran A, Cranston I, Lomas J, Macdonald I, Amiel Protection by lactate of cerebral function during hypoglycaemia. Lancet 1994;343:16– 20
- Suzuki A, Stern SA, Bozdagi O, et Astrocyteneuron lactate transport is required for long-term memory formation. Cell 2011;144:810–823
- Nasi A, Fekete T, Krishnamurthy A, et Dendritic cell reprogramming by endogenously produced lactic acid. J Immunol 2013;191:3090– 3099
- Country Retinal metabolism: a comparative look at energetics in the retina. Brain Res 2017;1672:50–57
- Vohra R, Aldana BI, Waagepetersen H, Bergersen LH, Kolko Dual properties of lactate in Műller cells: the effect of GPR81 activation. Invest Ophthalmol Vis Sci 2019;60:999–1008
- Gong J, Kelekar G, Shen J, Shen J, Kaur S, Mita The expanding role of metformin in cancer: an update on antitumor mechanisms and clinical development. Target Oncol 2016;11:447– 467
- Janzer A, German NJ, Gonzalez-Herrera KN, Asara JM, Haigis MC, Struhl Metformin and phenformin deplete tricarboxylic acid cycle and glycolytic intermediates during cell transformation and NTPs in cancer stem cells. Proc Natl Acad Sci U S A 2014;111:10574–10579
- Lipska KJ, Bailey CJ, Inzucchi Use of metformin in the setting of mild-to-moderate renal insufficiency. Diabetes Care 2011;34:1431–1437
- Bennis Y, Bodeau S, Batteux B, et A study of associations between plasma metformin concentration, lactic acidosis, and mortality in an emergency hospitalization context. Crit Care Med 2020;48:e1194–e1202
- Eppenga WL, Lalmohamed A, Geerts AF, et Risk of lactic acidosis or elevated lactate concentrations in metformin users with renal impairment: a population-based cohort study. Diabetes Care 2014;37:2218–2224
- DeFronzo R, Fleming GA, Chen K, Bicsak Metforminassociated lactic acidosis: current perspectives on causes and risk. Metabolism 2016;65:20–29
- National Institute for Health and Care Type 2 diabetes in adults: management. NICE guideline [NG28]. Accessed 14 February 2020. Available from https://www.nice. org.uk/ guidance/ng28/chapter/1-recommendations
- EkstrŐm N, SchiŐler L, Svensson A-M, et Effectiveness and safety of metformin in 51 675 patients with type 2 diabetes and different levels of renal function: a cohort study from the Swedish National Diabetes Register. BMJ Open 2012;2:e001076
- MacCallum L, Senior Safe use of metformin in adults with type 2 diabetes and chronic kidney disease: lower dosages and sick-day education are essential. Can J Diabetes 2019;43:76– 80
- Sun S, Li H, Chen J, Qian Lactic acid: no longer an inert and end-product of glycolysis. Physiology (Bethesda) 2017;32:453–463
- Goldenberg RM, Gilbert JD, Hramiak IM, Woo VC, Zinman Sodium-glucose co-transporter inhibitors, their role in type 1 diabetes treatment and a risk mitigation strategy for preventing diabetic ketoacidosis: the STOP DKA Protocol. Diabetes Obes Metab 2019;21:2192– 2202
Стаття надана мовою оригіналу






