
 Article
Article
 23.04.2025
23.04.2025
Роль холинергического дефицита в патогенезе психоневрологических заболеваний
Дзяк Л.А., Цуркаленко Е.С. ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина.
Резюме. Сделан обзор литературы, посвященной роли дисфункции холинергической системы в формировании различной патологии центральной нервной системы. Представлены данные о патогенетических механизмах нарушений сознания и когнитивных дисфункций. Описаны современные подходы к коррекции холинергической недостаточности.
Ключевые слова: холинергическая система; когнитивные нарушения; нарушения сознания; болезнь Альцгеймера; сосудистая деменция; обзор
Summary. A review of the literature on the role of dysfunction of the cholinergic system in the formation of various pathologies of the central nervous system is made. The data on the pathogenetic mechanisms of impaired consciousness and cognitive dysfunction are presented. Modern approaches to the correction of cholinergic deficiency are described.
Keywords: cholinergic system; cognitive impairment; disturbance of consciousness; Alzheimer’s disease; vascular dementia; review
Введение
Роль нарушений холинергической (ХЭ) регуляции в формировании неврологической патологии обусловлена распространенностью холинергических синапсов в структурах нервной системы с образованием массивных нейрональных сетей и целого комплекса разноуровневых проводящих путей. Нарушение комплексности работы этих систем и возникновение дисбаланса между заинтересованными структурами на любом уровне приводит к возникновению неврологической симптоматики различной степени выраженности, с тенденцией к прогрессированию и глобализации возникающих нарушений. Высокая представленность ХЭ-нейронов в структурах головного мозга, играющих ключевую роль в формировании когнитивных функций, включая неокортекс, обусловливает критическую важность холинергической передачи для временной и декларативной памяти, обучения и внимания. С учетом биохимии головного мозга, в которой ацетилхолин имеет широкую представленность, есть также основания полагать, что этот медиатор обеспечивает сложные двигательные функции — инициацию движения, двигательные стереотипы. Кроме того, ХЭ-система обеспечивает спонтанную активность, эмоциональное поведение, память и волевые акты. В недавних исследованиях обнаружено, что холинергические нейроны, локализованные в базальных отделах переднего мозга, моносинаптически проецируются на кору, обеспечивая баланс между реакциями торможения и активации, что является невероятно важным для понимания основ формирования сознания и патогенетических механизмов его нарушений.
Анатомо-физиологические особенности холинергической системы
Другая группа холинергических нейронов сконцентрирована в области покрышки среднего мозга и представлена педункулопонтинным ядром и смежными ядрами ствола мозга. Образуя многочисленные связи с гипоталамусом, гиппокампальной извилиной, миндалиной и префронтальной корой, данная холинергическая субсистема участвует в формировании циркадных ритмов и инициирует фазу быстрого сна (рис. 1).
/69.jpg)
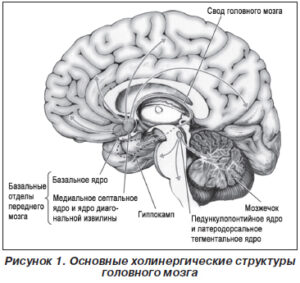
Ее активность максимальна в период бодрствования и уменьшается во время медленноволнового сна [63]. Уровень возбуждения холинергических нейронов переднего мозга, связанных с бодрствованием, меняется параллельно с поведенческой активностью животного. Частота их спайковых разрядов увеличивается во время бодрствования, и особенно во время движения, а также в парадоксальном сне [5]. В медленном сне их активность уменьшается. Концепция холинергических нейронов как источника кортикальной активации, поддерживающего бодрствование, должна быть дополнена представлением о существовании специального холинергического механизма, обеспечивающего дополнительное высвобождение АХ в локальных участках коры, которые реагируют на стимулы, связанные с подкреплением. Показано, что значительная часть нейронов базальных отделов переднего мозга реагирует активацией на условные раздражители, связанные с наградой, и не реагирует на условные сигналы наказания [59]. Это механизм избирательного внимания к значимым стимулам, который обеспечивает их обработку в соответствующих областях коры [60]. Опыты с фармакологическим отключением базального переднего мозга у животных показали нарушение поведения. Животные не могут использовать приобретенные ими навыки, включая прохождение различных лабиринтов, заученное пассивное и активное избегание [28]. Создавая локальную активацию в коре, холинергические нейроны взаимодействуют с таламокортикальной неспецифической системой. Предполагают, что, параллельно влияя на кору и таламус, они могут модулировать, в том числе усиливать реакции активации, определяемые механизмом таламокортикальной неспецифической системы. Холинергические активирующие влияния из базальных отделов переднего мозга распространяются также на лимбическую систему, в частности на гиппокамп, вызывая гиппокампальный тета-ритм — признак активации гиппокампа.
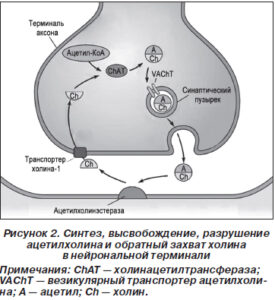
Холинергические нейроны вырабатывают холин-ацетилтрансферазу, которая транспортируется в проекционные зоны, где служит катализатором синтеза ацетилхолина. Ацетилхолин хранится в синаптических везикулах. Их диаметр 80 нм в холинергических синапсах, и содержат они около 40 тысяч молекул нейромедиатора. Его высвобождение при возбуждении происходит путем полного опорожнения каждой везикулы. Перенос ацетилхолина, содержащегося в цитозоле нейрона, в синаптический пузырек осуществляется под действием везикулярного транспортера ацетилхолина. Слияние мембраны везикул с пресинаптической мембраной обеспечивается увеличением концентрации ионов Са2+ внутри клетки, в результате чего происходит выброс нейромедиатора в синаптическую щель. Необходимо 4 иона Са2+ для выхода содержимого из одной везикулы. В синаптической щели ацетилхолин взаимодействует с рецептором, входящим в состав постсинаптической мембраны. Проницаемость постсинаптической мембраны изменяется: пропускная способность для ионов Nа+ резко увеличивается. Так запускается ряд реакций, обеспечивающих выполнение специфических функций. Избыток молекул нейромедиатора расщепляется ферментом ацетилхолинэстеразой (АХЭС), являющейся одним из самых быстрых известных науке ферментов. В результате гидролиза ацетилхолина образуются холин и уксусная кислота, абсорбирующиеся пресинаптической мембраной назад в пресинаптическую терминаль, где они повторно используются для синтеза ацетилхолина [34].
Роль холинергической системы в патологии центральной нервной системы
Возможности фармакологической коррекции холинергических нарушений
Список літератури
- Бачинская Н.Ю., Копчак О.О. Холинергическая стратегия в терапии когнитивных нарушений у пациентов пожилого и старческого возраста // Международный неврологический журнал. — 2014. — № 2 (64). — С. 84-92.
- Криштафор А.А. Когнитивные нарушения, обусловленные критическими состояниями, как проявление церебральной недостаточности // Медицина неотложных состояний. — 2015. — 2 (65).
- Макотрова Т.А. Роль α7 никотиновых ацетилхолиновых рецепторов в фармакотерапии нейродегенеративных заболеваний // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. — 2012. — Т. 112, № 10. — С. 57-59.
- Одинак М.М., Вознюк И.А., Пирадов М.А., Румянцева С.А. Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте // Клиническая неврология. — 2010. — 4 (1). — 20-7.
- Никонов В.В., Савицкая И.Б. Возможности применения холина альфосцерата для лечения постгипоксической энцефалопатии // Медицина неотложных состояний. — 2011. — № 1-2. — С. 101-106.
- Никонов В.В., Савицкая И.Б., Белецкий А.В. Холина альфосцерат в терапии острого ишемического инсульта // Мед. неотл. сост. — 2013. — № 1. — С. 94-98.
- Расулова Х.А. Особенности холинергической нейромедиации при ишемических инсультах в зависимости от их патогенетической гетерогенности // Міжнар. неврол. журн. — 2011. — № 3. — С. 55-59.
- Черний Т.В., Андронова И.А., Черний В.И. Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме // Международный неврологический журнал. — 2011. — № 2. — С. 40.
- Черний Т.В., Андронова И.А., Черний В.И. и др. Принципы коррекции холинергической недостаточности, развивающейся в восстановительном периоде лечения травматической болезни головного мозга и мозгового инсульта // Міжнар. неврол. журн. — 2012. — № 3. — С. 108-116.
- Abramochkin, Denis V., Anastasia A. Borodinova, Leonid V. Rosenshtraukh, Eugen E. Nikolsky. Both Neuronal and Non-Neuronal Acetylcholine Take Part in Non-Quantal Acetylcholine Release in the Rat Atrium // Life Sciences. — 2012. — 91 (21-22). — 1023-26.
- Amenta F., Tayebati S.K., Vitali D., Di Tullio M.A. Association with the cholinergic precursor choline alphoscerate and the cholinesterase inhibitor rivastigmine: an approach for enhancing cholinergic neurotransmission // Mech. Ageing. Dev. — 2006. — 127. — 173-179.
- Amenta F., Carotenuto A., Fasanaro A.M., Lanari A., Previdi P., Rea R. Analisi comparativa della sicurezza/efficacia degli inibitori delle colinesterasi e del precursore colinergico colina alfoscerato nelle demenze ad esordio nell’eta adulta // G. Gerontol. — 2010. — V. 58. — P. 64-68.
- Amenta F. et al. The ASCOMALVA trial: association between the cholinesterase inhibitor donepezil and the cholinergic precursor choline alphoscerate in Alzheimer’s disease with cerebrovascular injury: interim results // J. Neurol. Sci. — 2012. — 322 (1-2). — 96-101.
- Amenta F., Carotenuto A., Fasanaro A.M. et al. Исследование ASCOMALVA. Эффективность комбинированного применения ингибитора холинэстеразы и холина альфосцерата в отношении когнитивных расстройств при болезни Альцгеймера в сочетании с цереброваскулярным поражением головного мозга // Международный неврологический журнал. — 2014. — № 5 (67). — С. 50-58.
- Araujo Joseph A., Christa M. Studzinski, Norton W. Milgram. Further Evidence for the Cholinergic Hypothesis of Aging and Dementia from the Canine Model of Aging. Progress in Neuro-Psychopharmaco-logy and Biological Psychiatry, Canine Model оf Cognitive Aging: Further Developments аnd Practical Applications. — 2005. — 29 (3). — 411-22.
- Aspinall Richard. Aging of the Organs and Systems // Springer Science & Business Media. — 2013.
- Audrey Miang Ying Tan. Postoperative cognitive dysfunction after cardiac surgery / Audrey Miang Ying Tan, Derek Amoako // Contin. Educ. Anaesth. Crit. Care Pain. — 2013. — Vol. 13, Iss. 6. — P. 218-223.
- Bartus R.T., Dean R.L., Beer B., Lippa A. The cholinergic hypothesis of geriatric memory dysfunction // Science. — 1982. — 217 (4558). — P. 408-414.
- Behl P. et al. Strategic subcortical hyperintensities in cholinergic pathways and executive function decline in treated Alzheimer patients // Archives of Neurology. — 2007. — Vol. 64, № 2. — P. 266-272.
- Bond M. et al. The effectiveness and cost-effectiveness of donepezil, galantamine, rivastigmine and memantine for the treatment of Alzheimer’s disease (review of Technology Appraisal № 111): a systematic review and economic model // Health technology assessment (Winchester, England). — 2012. — Vol. 16, № 21. — P. 1-470.
- Bowler J.V. Vascular Cognitive Impairment // Stroke. — 2004. — 35. — 386-388.
- Bullock R. New drugs for Alzheimer’s disease and other dementias // Br. J. Psychiatry. — 2002. — 180. — 135-139.
- Bunce J.G., Sabolek H.R., Chrobak J.J. Intraseptal infusion of the cholinergic agonist carbachol impairs delayed-non-match-to-sample radial arm maze performance in the rat // Hippocampus. — 2004. — Vol. 14, № 4. — P. 450-459.
- Cuello A.C. Basal Forebrain Cholinergic Neurons // Encyclopedia of Psychopharmacology — Springer, Berlin-Heidelberg. — 2010. — P. 201-201.
- Cummings J. Cholinesterase Inhibitors: A New Class of Psychotropic Compounds // The American Journal of Psychiatry. — 2000. — Vol. 157 (1). — Р. 4-15.
- Dakroub Mouhamed. Cardioprotective Role of the Choli-nergic System // Electronic Thesis and Dissertation Repository. — 2015. — 3425.
- De Jesus Moreno Moreno M. Cognitive improvement in mild to moderate Alzheimer’s dementia after treatment with the acetylcholine precursor choline alfoscerate: a multicenter, double-blind, randomized, placebo-controlled trial // Clin. Ther. — 2003. — 25, 1. — 178-193.
- Dekker A.J., Connor D.J., Thal L.J. The role of cholinergic projections from the nucleus basalis in memory // Neurosci Biobehav. Rev. — 1991. — 15 (2). — 299-317.
- Di Bari M., Di Pinto G., Reale M., Mengod G., Tata A.M. Cholinergic System and Neuroinflammation: Implication in Multiple Sclerosis // Cent. Nerv. Syst. Agents. Med. Chem. — 2017. — 17 (2). — 109-115.
- Doggrell S.A., Evans S. Treatment of dementia with neurotransmission modulation // Expert Opin. Investig. Drugs. — 2003. — 12. — 1633-54.
- Dubois B., Albert M.L. Amnestic MCI or prodromal Alzheimer’s disease // Lancet Neurology. — 2004. — 3. — 246-8.
- Ehlenbach W.J. Association between Acute Care and Critical Illness Hospitalization and Cognitive Function in Older Adults / Ehlenbach W.J., Hough C.L., Crane P.K. et al. // JAMA. — 2010. — Vol. 303 (8). — P. 763-770.
- Galasko D. New approaches to diagnose and treat Alzheimer’s disease: a glimpse of the future // Clin. Geriatr. Med. — 2001. — 17 (2). — 393-410.
- Giboureau N. et al. PET radioligands for the vesicular acetylcholine transporter (VAChT) // Current topics in medicinal chemistry. — 2010. — Vol. 10, № 15. — P. 1569-1583.
- Grothe M., Heinsen H., Teipel S.J. Atrophy of the cholinergic basal forebrain over the adult age range and in early stages of Alzheimer’s disease // Biological psychiatry. — 2012. — Vol. 71, № 9. — P. 805-813.
- Fodale V., Santaria L.B., Schifilliti D., Mandel P.K. Anesthe-tics and postoperative cognitive dysfunction: a pathological mechanism mimicking Alzheimer’s disease // Anesthesia. — 2010. — V. 65 (4). — P. 388-395.
- Francis P. T., Ramirez M.J., Lai M.K. Neurochemical basis for symptomatic treatment of Alzheimer’s disease // Neuropharmacology. — 2010. — Vol. 59. — P. 221-229.
- Harald J. Hampel, M-Marsel Mesulam, Augusto Claudio Cuell, Zaven Khachaturian. The cholinergic system in the pathophysiology and treatment of Alzheimer’s disease // Brain. — 2018. — 141 (7).
- Hasselmo M.E. The role of acetylcholine in learning and me-mory // Current opinion in neurobiology. — 2006. — Vol. 16, № 6. — P. 710-715.
- Joshi D., Bhatia M., Gupta S. et al. Cognitive evaluation in myasthenia gravis: A P300 and neuropsychological study // Neurology Asia. — 2006. — Vol. 11. — P. 97-102.
- Kaltsatou A. et al. Cognitive impairment as a central choli-nergic deficit in patients with Myasthenia Gravis // BBA clinical. — 2015. — Vol. 3. — P. 299-303.
- Klein J.C. et al. Neurotransmitter changes in dementia with Lewy bodies and Parkinson disease dementia in vivo // Neurology. — 2010. — Vol. 74, № 11. — P. 885-892.
- Lulu Xie et al. Sleep drives metabolite clearance from the adult brain // Science. — 2013. — 342. — 373.
- Maniega S.M., Cvoro V., Armitage P.A. Choline and Creatine Are Not Reliable Denominators for Calculating Metabolite Ratios in Acute Ischemic // Stroke. — 2008.
- Mao Z. et al. Association between myasthenia gravis and cognitive function: A systematic review and meta-analysis // Annals of Indian Academy of Neurology. — 2015. — Vol. 18, № 2. — P. 131.
- Pákáski M., Kálmán J. Interactions between the amyloid and cholinergic mechanisms in Alzheimer’s disease // Neurochemistry international. — 2008. — Vol. 53, № 5. — P. 103-111.
- Pandharipande P.P. Long-Term Cognitive Impairment after Clinical Illness / P.P. Panharipande, T.D. Girard, J.C. Jackson et al. // N. Engl. J. Med. — 2013. — № 369. — C. 1306-1316.
- Pantoni L., Poggesi A., Inzitari D. The relation between white-matter lesions and cognition // Current opinion in neurology. — 2007. — Vol. 20, № 4. — P. 390-397.
- Parnetti L., Amenta F., Gallai V. Choline alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data // Mech. Ageing. Dev. — 2001. — 122. — 2041-55.
- Ranganath C., Rainer G. Neural mechanisms for detecting and remembering novel events // Nature Reviews Neuroscience. — 2003. — Vol. 4, № 3. — P. 193-202.
- Sato N., Sakamori M., Haga K., Takehara S., Setoguchi M. Antagonistic activity of Y-25130 on 5-HT3 receptors // Jpn. J. Pharmacol. — 1992. — 59 (4). — 443-8.
- Scapicchio P.L. // Int. J. Neurosci. — 2013. — 123 (7). — 444.
- Söderman A. et al. Activation of nicotinic α 7 acetylcholine receptor enhances long term potentation in wild type mice but not in APP swe/ PS1ΔE9 mice // Neuroscience letters. — 2011. — Vol. 487, № 3. — P. 325-329.
- Szymusiak R. Magnocellular nuclei of the basal forebrain: substrates of sleep and arousal regulation // Sleep. — 1995. — 18 (6). — 478-500.
- Tayebati S.K., Tomassoni D., Di Stefano A. et al. Effect of choline-containing phospholipids on brain cholinergic transporters in the rat // J. Neurol. Sci. — 2011. — V. 302. — P. 49-57.
- Vellas B., Messina J., Hartman R. et al. Multi-dimensionality of treatment benefits in Alzheimer’s disease: investigating the correlation between activities of daily living and cognition in patients treated with rivastigmine. Research and practice in Alzheimer’s disease. — Paris: Serdi Publishing; NY: Springer Publishing Company, 2001. — 193-204.
- Wess J., Eglen R.M., Gautam D. Muscarinic acetylcholine receptors: mutant mice provide new insights for drug development // Nature reviews Drug discovery. — 2007. — Vol. 6, № 9. — P. 721-733.
- Wessler I., Kirkpatrick C.J. Acetylcholine beyond neurons: the non-neuronal cholinergic system in humans // British journal of pharmacology. — 2008. — Vol. 154, № 8. — P. 1558-1571.
- Whalen P.J., Rauch S.L., Etcoff N.L., McInerney S.C., Lee M.B., Jenike M.A. Masked presentations of emotional facial expressions modulate amygdala activity without explicit knowledge // J. Neurosci. — 1998. — 18. — 411-418.
- Wilson F.A., Rolls E.T. Neuronal responses related to the novelty and familiarity of visual stimuli in the substantia innominata, diagonal band of Broca and periventricular region of the basal forebrain // Exp. Brain Res. — 1990. — 80. — 104-20.
- Wonnacott S., Barik J. Nicotinic ACh receptors // Tocris. Rev. — 2007. — Vol. 28. — P. 1-20.
- Woolf N.J., Butcher L.L. Cholinergic systems mediate action from movement to higher consciousness // Behavioural brain research. — 2011. — Vol. 221, № 2. — P. 488-498.
- Xu M. et al. Basal forebrain circuit for sleepwake control // Nature neuroscience. — 2015. — Vol. 18, № 11. — P. 1641-1647.
- Zaal I.J. Delirium in critically ill patients: epidemiology, pathophysiology, diagnosis and management / I.J. Zaal, A.J. Slooter // Drugs. — 2012. — № 72 (11). — P. 1457-1471.
Получено 13.03.2019
Стаття надана мовою оригіналу






