
 Article
Article
 22.04.2025
22.04.2025
Обґрунтування оптимального вибору препаратів для лікування остеоартрозу із супутньою гіперурикемією
Н.М. Шуба, Т.Д. Воронова, А.С. Крилова, Т.С. Хамбір, А.В. Пилипенко Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ.
Мета дослідження: визначення диференційованого підходу щодо лікування остеоартрозу (ОА) залежно від наявності гіперурикемії.
Матеріали та методи. Досліджено 176 пацієнтів (144 жінок, 32 чоловіків) з ОА колінних суглобів I–ІІІ рентгенологічної стадії за Kellgren–Lawrence. Тривалість захворювання становила 5,00 (IQR 4,00–10,00) року. Розподіл на 5 груп був проведений залежно від лікування. Пацієнти 1-ї групи (n=30) отримували німесулід у дозі 100 мг двічі на добу; 2-ї групи (n=30) – мелоксикам у дозі 15 мг 1 раз на добу протягом 14 днів; 3-ї групи (n=54) – діацереїн у дозі 50 мг двічі на добу, 4-ї групи (n=32) – хондроїтину сульфат (ХC) у дозі 500 мг двічі на добу протягом 6 міс; 5-ї групи (n=30) – глюкозаміну сульфат (ГС) 400 мг 3 рази на тиждень протягом 1,5 міс. Оцінено динаміку ВАШ, індексів WOMAC, Лекена, сечової кислоти, СРБ, IL-1, загальноклінічних показників. Статистичний аналіз проведено за допомогою SPSS Statistics.
Результати. У статті наведено сучасні дані літератури щодо поєднання ОА та гіперурикемії. Проаналізовано стадію ураження за рентгенологічними ознаками, клінічні особливості суглобового синдрому у хворих на ОА та гіперурикемію. Проведена характеристика найбільш поширених лікарських засобів при лікуванні ОА – нестероїдних протизапальних препаратів (німесулід, мелоксикам) і симптоматичних протизапальних препаратів (діацереїну, ХС, ГС). Доведена їхня ефективність за показниками суглобового синдрому, а саме: ВАШ, індексів Лекена, WOMAC. Досліджено вплив на рівень сечової кислоти, а також можливість застосування у разі гіперурикемії.
Заключення. У дослідженні було показано, що препаратом вибору для зняття больового синдрому протягом перших 14 днів є німесулід, який більш ефективний, ніж мелоксикам, а крім того зменшує рівень IL-1 (важливого прозапального фактору). Наявність гіперурикемії у хворих на ОА у 63,63% випадках призвів до більш тяжкого перебігу ОА. Застосування діацереїну у даної категорії хворих сприяло зниженню гіперурикемії, що дає перевагу діацереїну у лікуванні таких хворих. Водночас вживання ХС у таких хворих підвищує рівень сечової кислоти.
Ключові слова: остеоартроз, гіперурикемія, німесулід, діацереїн, хондроїтину сульфат.
Обоснование оптимального выбора препаратов для лечения остеоартроза с сопутствующей гиперурикемией
Н.М. Шуба, Т.Д. Воронова, А.С. Крылова, Т.С. Хамбир, А.В. Пилипенко
Цель исследования: определение дифференцированного подхода к лечению остеоартроза (ОА) в зависимости от наличия гиперурикемии.
Материалы и методы. Исследованы 176 пациентов (144 женщин, 32 мужчин) с ОА коленных суставов I–III рентгенологической стадии по Kellgren–Lawrence. Длительность заболевания составляла 5,00 (IQR 4,00–10,00) года. Деление на 5 групп был проведен в зависимости от лечения. Пациенты 1-й группы (n=30) принимали нимесулид в дозе 100 мг дважды в сутки; 2-й группы (n=30) – мелоксикам в дозе 15 мг 1 раз в сутки в течение 14 дней; 3-й группы (n=54) – диацереин в дозе 50 мг дважды в сутки; 4-й группы (n=32) – хондроитинсульфат (ХC) в дозе 500 мг дважды в сутки в течение 6 мес; 5-й группы (n=30) – глюкозамин сульфат (ГС) 400 мг 3 раза в неделю в течение 1,5 мес. Оценена динамика ВАШ, индексов WOMAC, Лекена, мочевой кислоты, СРБ, IL-1 , общеклинических показателей. Статистический анализ проведен с помощью SPSS Statistics.
Результаты. В статье приведены современные данные литературы о сочетании остеоартроза и гиперурикемии. Проанализирована стадия поражения по рентгенологическим признакам, клинические особенности суставного синдрома у больных с остеоартрозом и гиперурикемией. Приведена характеристика наиболее распространенных лекарственных средств при лечении остеоартроза – нестероидных противовоспалительных препаратов (нимесулида, мелоксикама) и симптоматических противовоспалительных препаратов (диацереина, хондроитин сульфата, глюкозамина сульфата). Показана их эффективность по показателям суставного синдрома, а именно ВАШ, индексов Лекена, WOMAC. Исследовано влияние на уровень мочевой кислоты, а также возможность применения при гиперурикемии.
Заключение. В исследовании было показано, что препаратом выбора для снятия болевого синдрома в течение первых 14 дней является нимесулид, который более эффективен, чем мелоксикам, а кроме того снижает уровень IL-1 (важного провоспалительных фактора). Наличие гиперурикемии у больных с ОА в 63,63% случаев привел к более тяжелому течению ОА. Применение диацереина у данной категории больных привело к снижению гиперурикемии, что дает преимущество диацереину в лечении таких больных. В то же время использование ХС у таких больных повышает уровень мочевой кислоты.
Ключевые слова: остеоартрит, гиперурикемия, нимесулид, диацереин, хондроитин сульфат.
Grounding optimal choice of the drugs for the treatment of osteoarthritis with hyperuricemia
N. Shuba, T. Voronova, A. Krylova, T. Khambir, A. Pilipenko
The objective: differentiated approach to the treatment of OA depending of presence of hyperuricemia.
Patients and methods. Was exanimated 176 patients (144 women, 32 men), aged (59,71±0,86) years with confirmed radiographic OA according to Kellgren and Lawrence scale. Division into groups was performed depending on treatment. For 14 days group 1 (n=30) had been received nimesulide 100 mg twice daily, and group 2 (n=30) – meloxicam 15 mg 1 time a day. For 6 months 3rd group (n=54) had been received diacerein 50 mg twice a day and the 4th group (n=32) – chondroitine sulfate (CS) 500 mg twice daily. 5th group (n=30) had been received glucosamine sulfate (GS) 400 mg 3 times per week for 1,5 months. Was estimated dynamics of VAS, WOMAC, Lequesne, uric acid (UA), CRP, IL-1b, ESR, biochemical indicators. Statistical analysis – SPSS Statistics.
Results. The article presents the current data on the combination of hyperuricemia and osteoarthritis. Was analyzed stage lesions by radiographic characteristics, clinical features articular syndrome in patients with osteoarthritis and hyperuricemia. The article presents the characteristics of the most common drugs in the treatment of osteoarthritis – NSAIDs (nimesulide, meloxicam) and symptomatic anti-inflammatory drugs (including diacerein, chondroitin sulfate, glucosamine sulfate). Was investigated efficacy by indicators of articular syndrome, such as VAS, indices Lequesne, WOMAC. As well as effects on uric acid levels and the opportunity of use in patients with hyperuricemia.
Conclusions. Was showed that nimesulide is more effective than meloxicam during first 14 days, and reduces IL-1 , an important proinflammatory factor. The presence of hyperuricemia in 63,63% patients with OA, resulted in a more severe OA. Diacerein decreases UA, given an advantage in treatment these patients, which isn`t presented with CS (which increased the level of UA
Key words: osteoarthritis, hyperuricemia, nimesulide, diacerein, chondroitin sulfate.
Остеоартроз (ОА) є найбільш поширеним та найбільш інвалідизуючим захворюванням суглобів у світі. Поширеність ОА збільшується з кожним роком. За результатами епідеміологічних досліджень у США протягом останнього десятиліття зросла з 21 до 27 млн чоловік серед дорослого населення [17].
Захворюваність ОА значно вища у людей похилого віку з коморбідними метаболічними порушеннями, у тому числі гіперурикемією. Існує думка, що ОА може бути пов’язаний або з метаболічним синдромом (до його складу входить підвищений рівень сечової кислоти), або з кожним із його компонентів [18]. Останнє десятиліття все більше почали приділяти уваги взаємозв’язку ОА з гіперурикемією. Підвищений рівень сечової кислоти асоціюється з генералізованим ОА у хворих, які перенесли ендопротезування кульшового суглоба [21], тісний зв’язок було також продемонстровано між тяжкістю ОА і рівнем сечової кислоти синовіальної рідини у пацієнтів з гонартрозом і відсутністю в анамнезі подагри [11]. У 2013 році була виявлена асоціація між гіперурикемією та ОА колінних суглобів [9], у 2016 році були опубліковані дані щодо підвищення рівня сечової кислоти у пацієнток з ОА [12].
Рівень сечової кислоти у синовіальній рідині корелює з IL-1b. Солі моноурату натрію стимулюють інфламасоми та каспазу-1 у моноцитах та синовіальних мононуклеарних клітинах з активацією IL-1b [16]. Утворення IL-1b підвищує приплив нейтрофільних гранулоцитів у суглоб та розвиток запалення [10]. Кристали моноурата натрію також стимулюють синтез моноцитами та синовіоцитами і TNF-a. Прозапальні цитокіни у свою чергу викликають розвиток хронічного синовіїту, запалення периартикулярних тканин та спричинюють поступове руйнуванню хряща, а отже розвиток вторинного АО [13].
Призначення ефективної терапії у хворих на ОА завжди було складною проблемою. На сьогодні медикаментозне лікування ОА проводиться препаратами, які розподіляють на дві групи: модифікуючі симптоми захворювання (симптоматичні) – швидко діючі і повільно діючі (symptomatic slow acting drugs for osteoarthritis – SYSADOA) та модифікуючі хворобу (патогенетичні) [1]. До першої групи належать симптоматичні препарати швидкої дії, а саме: аналгетики та нестероїдні протизапальні препарати (НПЗП), що здатні зменшувати інтенсивність болю, припухлість, скутість і покращувати функцію суглобів.
На сьогодні все більш значне місце в терапії ОА належить симптоматичним препаратам повільної дії (SYSАDOA). У рекомендаціях ESCEO (Європейська спільнота з клінічних та економічних аспектів остеопорозу та ОА) 2014 року, рецептурні препарати даної групи були включені до алгоритму лікування ОА [7]. У 2016 році була підтверджена їхня ефективність внаслідок вивчення результатів клінічних досліджень щодо впливу на симптоми та структуру ОА препаратів різних груп, у тому числі SYSАDOA [20]. Проте вплив даних препаратів на гіперурикемію залишається ще недостатньо вивченим.
Існують дані щодо застосування німесуліду при гострому і хронічному подагричному артриті [2, 14]. Дуже важливо, що призначення препарату дозволяло домогтися зворотного розвитку проявів артриту навіть у тих пацієнтів, у яких була недостатньо ефективна попередня терапія високими дозами диклофенаку. За даними авторів, німесулід не впливав на пуриновий обмін, а саме на рівні сечової кислоти, креатиніну та його кліренсу.
Досліджували вплив і хондроїтину сульфат (ХС) на рівень сечової кислоти. H.M. Burt і Y.C. Dutt [8] виявили, що ХС і фосфатидилхолін сприяли кристалізації солей моноурата натрію in vitro, що приводило до їхнього депонування у тканинах. У їхньому дослідженні була використана суміш із двох ізомерів ХС, хондроїтин-4-сульфат та хондроїтин-6-сульфат у невідомих пропорціях, тому не виключено, що ці два ізомера можуть мати зовсім різний вплив на депонування кристалів сечової кислоти. Т.С. Laurent та А.Е. Denoble [11, 15] підтвердили, що сечова кислота in vitro була менш розчинна із збільшенням у синовіальній рідині кількості ХС. Крім того, ХС має тваринне походження. Гідрофільний сульфатований глікозамінглікан може бути отриманий з натуральних джерел (пташиний, бичачий, акулячий хрящ, які мають різне співвідношення хондроїтин-4-сульфат до хондроїтин-6-сульфат) або в лабораторних умовах [3], тобто багатий на пурини, що також впливає на підвищення рівня сечової кислоти.
Завдяки своїм протизапальним властивостям діацереїн призначають і при комбінації ОА та подагри або гіперурикемії [4]. Згідно з останніми дослідженнями, діацереїн може бути застосований для попередження рецидиву подагричного артриту та загострення подагри як монотерапія, або у комбінації з іншими уратзнижувальними чи протизапальними препаратами. На сьогодні проводять дослідження, в якому пропонують лікування подагричного артриту комбінацією діацереїну з фебуксостатом, розглядають питання щодо включення до комплексного лікування подагри препаратів з групи, до якої входять діацереїн або реїн [6, 19].
Проте вплив глюкозаміну сульфат (ГС) на гіперурикемію залишається ще недостатньо вивченим. Так, при вживанні ГС рівень сечової кислоти не змінювався за даними літератури, а за даними FDA на 2017 рік серед 674 пацієнтів, які застосовували ГС лише 13 (1,93%) з них констатували в якості побічної дії погіршення симптомів подагри.
Аналіз сучасної терапії ОА став приводом для вивчення особливостей перебігу ОА при гіперурикемії та ефективності НПЗП і симптоматичних повільнодіючих протизапальних препаратів при лікуванні ОА із супутньою гіперурикемією.
Мета дослідження: визначення диференційованого підходу щодо терапії ОА залежно від наявності гіперурикемії.
МАТЕРІАЛИ ТА МЕТОДИ
У дослідження увійшли 176 пацієнтів (жінок – 144, чоловіків – 32) з ОА колінних суглобів I–ІІІ рентгенологічної стадії за Kellgren–Lawrence. Діагноз ОА встановлювали за критеріями Американського коледжу ревматологів (ACR) 1986 року та Європейської антиревматичної ліги (EULAR) 2010 року перегляду. Усім пацієнтам проводили рентгенологічне дослідження колінних суглобів у прямій (передньо-задній) і боковій проекції за допомогою стаціонарного рентгенівського апарата Sirescop CX (ВАТ «Київський завод реле та автоматики», Україна, 1999) у положенні стоячи без навантаження на досліджуваний суглоб при згинанні коліна на 30°. Стадію ураження визначали за класифікацією J.H. Kellgren та J.S. Lawrence (1957).
Розподіл на 5 груп був проведений залежно від лікування:
- – а група (n=30) – пацієнти вживали німесулід (Німесил, «Берлін-Хемі АГ/Менаріні Груп», Німеччина) у дозі 100 мг двічі на добу;
- – а група (n=30) – хворі застосовували мелоксикам (Ревмоксикам, ПАТ «Фармак», Україна) у дозі 15 мг 1 раз на добу протягом 14 днів4
- – я група (n=54) – пацієнти вживали діацереїн (Флекцерин, ПАТ «Київський вітамінний завод», номер реєстраційного посвідчення UA/12618/01/01) у дозі 50 мг двічі на добу;
- – а група (n=32) – хворі застосовували хондроїтину сульфат-4,6 пташиного походження (Структум, PierreFabreMedicament, номер реєстраційного посвідчення Р.01.03/05713) у дозі 500 мг двічі на добу протягом 6 міс;
- – а група (n=30) – пацієнти вживали ГС (Сінарта, ПАТ «Фармак», Україна) у дозі 400 мг тричі на тиждень протягом 1,5 міс.
Оцінено динаміку:
- загальноклінічних показників: збір скарг та анамнезу, об’єктивне обстеження, оцінювання астрологічного статусу хворих, анкетування (заповнення пацієнтами адаптованих опитувальників WOMAC, Лекена, ВАШ);
- лабораторних: показників ліпідного (холестерин) та вуглеводного обміну (глюкоза крові), печінкові маркери (білірубін, АЛТ, АСТ), креатинін, сечова кислота в крові, С-реактивний білок (СРБ).
Визначення у сироватці крові рівня IL-1b (Bender MedSystems GmbH, Австрія) проводили методом твердофазної ферментної аглютинації, використовуючи діагностичні набори реагентів згідно з інструкцією. Облік реакції проводили на імуноферментному аналізаторі Lab-line-100 (WestMedica, Австрія).
Відповідність розподілу даних клінічного дослідження закону нормального розподілу перевіряли тестом Колмогорова–Смірнова. Для опису даних використовували медіану та міжквартильний інтервал (Me, IQR), за нормального розподілу – середнє арифметичне значення та стандартну похибку (M±m), частоту та стандартна похибку (Р±m). Оскільки отримані в результаті клінічного дослідження дані мали відхилення від нормального розподілу варіаційного ряду, для порівняння груп ми використовували непараметричні методи статистики – U-критерій Манна–Уітні (для незалежних груп) та критерій Вілкоксона (для залежних груп).
Для дослідження взаємозв’язку кількісних показників використовували кореляційний аналіз, знаходили критерій Спірмена (r), для якісних – використовували аналіз таблиць спряженості, знаходили критерій c2, силу взаємозв’язку j та відносний ризик RR, 95% CI. Застосовували програмно-математичний комплекс для персонального комп’ютера «Microsoft Excel 2007» (Microsoft) та комп’ютерні програми для статистичного аналізу та оброблення даних «STATISTICA® 6.0» (StatSoftInc., США), «SPSS Statistics 20» (IBM, США).
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
У результаті дослідження у 63,63% обстежених пацієнтів була виявлена гіперурикемія. Тому було проведено порівняння показників рівня сечової кислоти і показників ІМТ, рівнів болю за ВАШ і WOMAC, тривалості скутості та обмеження повсякденної активності за WOMAC, індексу Лекена, рентгенологічної стадії, рівнів С-реактивного білку, ШОЕ, IL-1 у хворих на ОА з гіперурикемією та без неї.
Аналізуючи важкість ураження за рентгенологічними ознаками, можна зазначити, що хворі на ОА (n=64) та ОА з гіперурикемією (n=112) мали переважно ІІ стадію за класифікацією J.H. Kellgren та J.S. Lawrence (64% та 66% відповідно). Проте слід зазначити, що у другій групі із більшою частотою спостерігалась ІІІ рентгенологічна стадія – 26% порівняно з 1-ю групою – 14% (табл. 1).
Таблиця 1. Розподіл хворих на ОА і гіперурикемію за ренгенологічною стадією
|
Рентгенологічна стадія хвороби |
Пацієнти | |||
| ОА | ОА і гіперурикемія | |||
| Абс. число | % | Абс. число | % | |
| І | 14 | 22 | 9 | 8 |
| ІІ | 41 | 64 | 74 | 66 |
| ІІІ | 9 | 14 | 29 | 26 |
| Разом | 64 | 100 | 112 | 100 |
Більш детальний аналіз характеру ураження опорно-рухового апарату свідчить про більшу частоту олігоартрозного ураження в обох групах (67% та 51% відповідно). У хворих з поєднаною патологією було виявлено більшу частоту виникнення поліостеоартрозу (45%), ніж у пацієнтів лише з ОА (21%). Моноартроз спостерігали у невеликого відсотка в обох групах.
Було виявлено відмінності у клінічній картині ОА у хворих із супутньою гіперурикемією. Спостерігали достовірно більш виражений больовий синдром. Так, рівень болю за ВАШ у хворих на ОА та гіперурикемію був достовірно вищим (р<0,001), ніж у пацієнтів на ОА з нормальним рівнем сечової кислоти у середньому на 11,1%. Індекс Лекена даної групи також був вищим у середньому на 22% порівняно із пацієнтами без гіперурикемії (табл. 2).
Таблиця 2. Показники артрологічного статусу в обстежених хворих
|
Показник |
ОА, n=64 | ОА і гіперурикемія, n=112 | Критерій
МаннаQУітні, U |
Рівень
значущості, р* |
||
| Me | IQR | Me | IQR | |||
| ВАШ, мм (0-100) | 54,00 | 48,00-58,00 | 60,00 | 56,00-65,75 | 553,5 | 0,001 |
| Індекс Лекена, бали (0-25) | 9,00 | 7,75-12,00 | 11,00 | 9,0-12,25 | 1213,5 | 0,049 |
| WOMAC (біль), мм(0-500) | 220,00 | 179,25-246,75 | 241,0 | 218,0-287,750 | 1171,5 | 0,028 |
| WOMAC (скутість), мм(0-200) | 96,00 | 70,50-114,00 | 114,0 | 69,5-138,0 | 1156 | 0,022 |
| WOMAC (функціональна
активність), мм(0-1700) |
727,00 | 578,75-844,25 | 766,0 | 692,0-890,0 | 1173,0 | 0,029 |
| WOMAC (сумарний), мм (0-2400) | 1040,5 | 852,5-1126,0 | 1148,0 | 1004,75-1261,5 | 1088,5 |
0,007 |
Примітка: * – різниця достовірна при р<0,05.
Крім того, рівень болю за індексом WOMAC у хворих із супутньою гіперурикемією також виявився вищим (р<0,05), ніж в осіб з нормальним рівнем сечової кислоти у середньому на 9,5% (див. табл. 2). Показник обмеженості рухливості суглоба вранці і протягом дня за WOMAC у пацієнтів з гіперурикемією був також достовірно вищим (р<0,05), ніж в осіб без неї, у середньому на 18%. Показник обмеження повсякденної активності за WOMAC у осіб на ОА та гіперурикемію був достовірно вищим (р<0,001), ніж у хворих на ОА із нормальним рівнем сечової кислоти у середньому на 5,3%. Таким чином, сумарний індекс WOMAC у пацієнтів з гіперурикемією був достовірно вищим (р<0,001) у середньому на 10,3% у порівнянні з особами з нормальним рівнем сечової кислоти.
У хворих на ОА рівень ШОЕ не перевищував норму та складав 12,5 (IQR: 8,00–17,00) мм/год, у той самий час, як у хворих із супутньою гіперурикемією він був вищий – 15,00 (IQR: 8,00–21,5) мм/год, хоча і статистично недостовірно.
Слід зазначити, що СРБ був значно вищий (р<0,0001) – 6,4 (IQR: 5,00–9,00) мг/л у пацієнтів з гіперурикемією порівняно з хворими на ОА із нормальним рівнем сечової кислоти – 4,0 (IQR: 3,00–6,00) мг/л.
Під час дослідження прозапальних цитокінів було виявлено, що IL-1 статистично достовірно (р<0,0001) більше, ніж в 1,5 разу був вищий у пацієнтів на ОА з гіперурикемією: 11,0 (5,75–16,0) пг/мл та 19,6 (IQR:13,4–24,09) пг/мл відповідно.
Дані результати можуть свідчити про наявність більш вираженого запального процесу у пацієнтів з ОА та гіперурикемією.
Отже, пацієнти з ОА з гіперурикемією мали більш виражену рентгенологічну стадію порівняно з хворими на ОА без гіперурикемії. Для пацієнтів з ОА з гіперурикемією більш характерний поліостеоартроз та менший відсоток моноартрозу. Дані клінічного обстеження показали, що пацієнти на ОА з гіперурикемією відрізнялися більш тяжким перебігом ОА, а саме: вираженістю болю за ВАШ та WOMAC, більшими показниками індексу Лекена та обмеженістю функціональної активності за індексом WOMAC. Хворі на ОА з гіперурикемією характеризувалися наявністю більш вираженого запального процесу (за даними СРБ, ШОЕ, IL-1 ). Отже надалі ми вивчали ефективність НПЗП та симптоматичних повільнодіючих протизапальних препаратів при лікуванні ОА із супутньою гіперурикемією.
Було проведено дослідження щодо вивчення ефективності німесуліду (1-а група) та мелоксикаму (2-а група). На тлі проведеної терапії відзначено достовірне зменшення вираженості больового синдрому за ВАШ: під час вживання німесуліду – на 35,6%, при застосуванні мелоксикаму – на 13,34%. При оцінюванні альгофункціонального індексу Lequesne виявлено статистично достовірне зменшення вираженості болю на 30,3% через 2 тиж вживання німесуліду, а в пацієнтів, які приймали мелоксикам, – на 25,7% через 2 тижні лікування (табл. 3).
Таблиця 3. Динаміка суглобового синдрому та імунологічних показників у хворих на ОА в результаті лікування німесулідом і мелоксикамом
|
Показник |
Німесулід, n=30 | Мелоксикам, n=30 | ||||||
| До лікування | Після лікування | До лікування | Після лікування | |||||
| Me | IQR | Me | IQR | Me | IQR | Me | Me | |
| ВАШ, мм | 57,5 | 53,5-65,5 | 35* | 31,25-42,25 | 60,00 | 57,00-67,00 | 55,00* | 57,5 |
| WOMAC, мм: | ||||||||
| Біль | 193,00 | 117,5-340,25 | 91,00* | 48,75-160,75 | 342,50 | 51,75-434,75 | 197,00* | 26,25-261,50 |
| Скутість | 100,00 | 76,75-111,00 | 68,5* | 48,00-88,00 | 93,00 | 14,00-107,50 | 64,00* | 11,25-87,75 |
| Функціональна
недостатність |
725,00 | 332,25-1167,75 | 414,00* | 166,25-734,00 | 646,00 | 64,00 | 436,50* | 44,25-577,00 |
|
Індекс Лекена, бали |
9,5 | 8,00-12,75 | 6,5* | 5,25-9,00 | 11,00 | 8,00-14,00 | 8,00* |
6,00-11,00 |
Примітка: * – р<0,001 при використанні критерію Вілкоксона.
На фоні лікування німесулідом було відмічено достовірне зменшення вираженості болю на 53,9%, скутості – на 29,7% і функціональних порушень – на 41,6%. У пацієнтів, які вживали мелоксикам, інтенсивність зменшення болю, скутості і функціональних порушень була менш вираженою: біль – на 37,3%, скутість – на 20%, функціональні порушення – на 26,6% через 2 тиж лікування (див. табл. 3).
Виявлено статистично достовірне зниження рівнів CРБ у плазмі крові – у групі німесуліду – на 64,4%, у групі мелоксикаму – на 50,48%, що може свідчити про зниження запальної відповіді в обох групах. Під час вживання німесуліду виявлено статистично достовірне зниження рівня IL-1 на 14% (з 22,63 (IQR: 12,75–34,15) пг/мл до 17,06 (IQR: 11,08–29,84) пг/мл, на відміну від групи із застосуванням мелоксикаму, де рівень IL-1 не змінювався: з 22,63 (IQR: 17,43–32,43) пг/мл до 23,54 (IQR:17,32–32,58) пг/мл.
Результати аналізу даних біохімічних показників крові (білірубін, АЛТ, АСТ, глюкоза, креатинін) свідчать про те, що при застосуванні обох препаратів статистично достовірних змін даних не виявлено (табл. 4).
Таблиця 4. Динаміка біохімічних показників крові у хворих на ОА в результаті лікування німесулідом і мелоксикамом
| Показник | Німесулід, n=30 | Мелоксикам, n=30 | ||
| До лікування | Після лікування | До лікування | Після лікування | |
| Білірубін, мкмоль/л | 17,59±0,55 | 17,59±0,55 | 17,01±0,9 | 16,81±0,89 |
| АлАТ, мккат/л | 0,12±0,007 | 0,13±0,009 | 0,19±0,02 | 0,19±0,02 |
| АсАТ, мккат/л | 0,17±0,05 | 0,17±0,05 | 0,18±0,022 | 0,21±0,026 |
| Глюкоза, ммоль/л | 5,1±0,16 | 5,05±0,12 | 5,03±0,22 | 5,14±0,23 |
| Креатинін, мкмоль/л | 92,6±3,24 | 92,2±2,74 | 90,9±1,94 |
91,1±2,13 |
Примітка: * – р<0,001 при використанні критерію Вілкоксона.
Проте відмічена тенденція до зниження рівня сечової кислоти з 375,33±24,6 мкмоль/л до 321,57±19,6 мкмоль/л після застосування німесуліда, у той час як мелоксикам не впливав на її рівень, що може бути корисним при лікуванні пацієнтів з гіперурикемією.
Було проведено дослідження щодо вивчення ефективності діцереїну (3-я група) у 54 хворих (49 жінок і 5 чоловіків) віком від 30 до 75 років з I–III рентгенологічною стадією за Kellgren–Lawrence.
У результаті дослідження виявлено позитивний вплив діацереїну на динаміку показників суглобового синдрому, а саме: статистично достовірне зниження вираженості болю за WOMAC – на 46,7%, скутості – на 50,2%, покращення функціональної активності – на 27,6% (табл. 5).
Таблиця 5. Динаміка показників індексу WOMAC у пацієнтів на тлі застосування діацереїну
|
Показник |
До лікування | Через 3 міс | Через 6 міс | |||
| Me | IQR | Me | IQR | Me | IQR | |
| WOMAC (біль), мм(0-500) | 238,00 | 217,25-287,75 | 186,00* | 125,00-202,25 | 130,50* | 98,00-168,50 |
| WOMAC (скутість),мм(0-200) | 114,00 | 92,00-134,25 | 68,00* | 55,50-76,00 | 56,50* | 46,00-68,00 |
| WOMAC (функціональна активність), мм(0-1700) | 765,50 | 612,00-902,75 | 617,00* | 528,00-692,00 | 578,00* | 437,00-643,50 |
| Сумарний індекс WOMAC(0-2400) | 1115,5 | 920,00-1312,25 | 852,00* | 721,75-969,25 | 750,00* |
657,50-858,00 |
Примітка: * – р<0,001; різниця вважається достовірною при р<0,05.
Серед показників запального процесу також було оцінено динаміку СРБ та ШОЕ на фоні лікування діацереїном. Рівень СРБ статистично достовірно (р<0,001) знизився з 5,6 (IQR: 3,6–8,00) мг/л до 3,00 (IQR: 1,95–4,30) мг/л після лікування. Також статистично достовірно (р<0,001) знизився і рівень ШОЕ з 15,00 (IQR: 10,00–25,00) мм/год до 12,00 (IQR: 10,00–18,00) мм/год. Наприкінці дослідження, через 6 міс лікування, ми отримали статистично достовірне зниження рівня IL-1 з 19,47 (IQR: 15,22–23,81) пг/мл до 12,00 (IQR: 9,00–16,20) пг/мл. Отримані результати підтверджують властивість діацереїну знижувати інтенсивність запального процесу.
Не було відмічено динаміки лабораторних показників ліпідного обміну, білірубіну, печінкових маркерів, креатиніну та його кліренсу, що свідчить про можливість безпечного застосування препарату у пацієнтів із супутньою патологією, а статистично достовірне зниження рівня глюкози крові – у пацієнтів із цукровим діабетом ІІ типу. При застосуванні діацереїну констатували зниження рівня сечової кислоти, що важливо при лікуванні хворих із супутньою гіперурикемією (табл. 6).
Таблиця 6. Динаміка загальноклінічних показників до та після лікування діацереїном
| Показник | До лікування | Після лікування | Рівень значущості, р* | ||
| Me | IQR | Me | IQR | ||
| Білірубін, мкмоль/л | 16,0 | 12,35-17,05 | 16,0 | 10,15-17,25 | 0,711 |
| АлАТ | 0,12 | 0,11-0,14 | 0,12 | 0,11-0,14 | 0,873 |
| АсАТ | 0,12 | 0,107-0,14 | 0,12 | 0,08-0,15 | 0,383 |
| Холестерин, ммоль/л | 5,4 | 4,3-6,23 | 5,0 | 4,1-6,0 | 0,912 |
| Глюкоза, ммоль/л | 5,1 | 4,8-5,8 | 4,98 | 4,00-5,40 | 0,001 |
| Креатинін, мкмоль/л | 84,00 | 76,00-97,00 | 84,00 | 74,00-94,00 | 0,149 |
| Кліренс креатиніну, мл/хв | 77,00 | 63,75-92,25 | 82,00 | 68,00-96,75 | 0,125 |
| Сечова кислота, мкмоль/л | 415,50 | 347,00-452,5 | 374,00 | 318,75-423,50 |
0,001 |
Примітка: * – різниця вважається достовірною при р<0,05.
З метою вивчення ефективності ХС (4-а група) у хворих на ОА були оцінені результати дослідження за участю 32 хворих (26 жінок і 6 чоловіків) віком від 35 до 75 років з I–III рентгенологічною стадією за Kellgren–Lawrence. Тривалість захворювання пацієнтів цієї групи – від 5 до 10 років.
Як видно з наведених даних, хондроїтин сульфат-4,6 довів досить високу ефективність через 6 міс, а саме: зменшення болю (26,4%), скутості (50,6%) та відновлення функціональної активності (11,4%) при лікуванні гонартрозу (табл. 7).
Таблиця 7. Динаміка показників індексу WOMAC у пацієнтів на фоні застосування ХС
| Показник | До лікування | Через 3 міс | Через 6 міс | |||
| Me | IQR | Me | IQR | Me | IQR | |
| WOMAC (біль), мм(0-500) | 243,00 | 225,00-272,75 | 215,00* | 196,50-227,50 | 194,00* | 174,00-198,00 |
| WOMAC(скутість),мм(0-200) | 116,00 | 96,00-140,25 | 67,00* | 63,25-71,75 | 63,00* | 49,50-68,00 |
| WOMAC (функціональна
активність), мм(0-1700) |
751,00 | 737,75-785,50 | 718,50* | 696,00-731,00 | 686,50* | 674,00-697,75 |
| Сумарний WOMAC, мм(0-2400) | 1127,0 | 1082,50-1207,25 | 1001,50* | 973,0-1040,5 | 937,50* |
908,75-962,50 |
Примітка: * – різниця вважається достовірною при р<0,05.
Наприкінці дослідження, через 6 міс лікування, ми отримали статистично достовірне (р<0,001) зниження рівня IL-1 з 20,00 (IQR: 11,50–26,52) пг/мл до 16,70 (IQR: 9,80–18,62) пг/мл. При дослідженні інших показників запалення було виявлено, що рівень ШОЕ статистично достовірно не змінювався протягом дослідження: 15,00 (IQR: 8,00–17,75) мм/год на початку лікування та 12,00 (IQR:10,00–18,00) мм/год після проведеної терапії. І лише рівень СРБ статистично достовірно (р<0,001) знизився з 6,0 (IQR: 3,25–9,00) мг/л до 3,10 (IQR: 1,81–6,00) мг/л після вживання ХС протягом 6 міс.
Не було відмічено динаміки лабораторних показників глюкози крові, ліпідного обміну, білірубіну, печінкових маркерів, які у більшості хворих до включення у дослідження були в межах норми, що важливо для пацієнтів з ОА, які мають супутню патологію (табл. 8).
Таблиця 8. Динаміка загальноклінічних показників у хворих на ОА до та після лікування ХС
| Показник | До лікування | Після лікування | Рівень значущості, р* | ||
| Me | IQR | Me | IQR | ||
| Білірубін, мкмоль/л | 16,10 | 12,80-16,80 | 16,00 | 13,00-17,00 | 0,384 |
| АлАТ | 0,125 | 0,10-0,14 | 0,12 | 0,11-0,14 | 0,616 |
| АсАТ | 0,12 | 0,083-0,140 | 0,12 | 0,11-0,14 | 0,940 |
| Холестерин, ммоль/л | 5,85 | 5,20-6,70 | 6,0 | 5,00-6,00 | 0,06 |
| Глюкоза, ммоль/л | 5,55 | 4,56-6,53 | 6,00 | 5,00-6,00 |
0,926 |
Примітка: * – різниця вважається достовірною при р<0,05.
У дослідженні було проаналізовано впливу ХС на пуриновий обмін (зокрема рівень сечової кислоти). Під час оцінювання показників пуринового обміну, а саме креатиніну та його кліренсу, динаміка не спостерігалась. Проте було виявлено статистично достовірне (р<0,001) підвищення рівня сечової кислоти, яка до лікування була 404,00 (IQR: 292,25–533,00) мкмоль/л, після лікування ХС – 437,00 (IQR: 365,75–547,5) мкмоль/л (табл. 9).
Таблиця 9. Динаміка показників пуринового обміну на фоні лікування ХС
| Показник | До лікування | Після лікування | Рівень значущості, р* | ||
| Me | IQR | Me | IQR | ||
| Креатинін, мкмоль/л | 84,00 | 75,00-99,25 | 87,00 | 82,00-96,00 | 0,261 |
| Кліренс креатиніну, мл/хв | 91,00 | 69,75-102,75 | 81,00 | 70,75-98,75 | 0,210 |
| Сечова кислота, мкмоль/л | 404,00 | 292,25-533,00 | 437,00 | 365,75-547,5 |
0,001 |
Примітка: * – різниця вважається достовірною при р<0,05.
Як видно з наведених даних, ХС достовірно підвищує рівень сечової кислоти у хворих на ОА з гіперурикемією. Проте не підвищує рівень сечової кислоти у хворих з її нормальним вмістом за даними дослідження, яке було проведено на базі Київської міської клінічної лікарні № 7 у 2015 році (Н.М. Шуба, А.С. Крилова, 2015).
Було проведено дослідження ефективності вітчизняного ГС (5-а група). У дослідженні брали участь 30 хворих (18 жінок і 12 чоловіків) віком від 29 до 80 років.
Через 1,5 міс після терапії ГС показники ВАШ у спокої зменшилися на 33%, під час ходьби – на 31%. Оцінюючи тяжкість гонартрозу за допомогою альгофункціонального індексу Лекена, було встановлено, що у процесі лікування показники достовірно зменшились на 35%. Через 1,5 міс після лікування ГС було констатовано їхнє вірогідне зниження. Зокрема показники індексу WOMAC (біль) зменшилися на 40%, WOMAC (скутість) – на 49%, WOMAC (функціональна активність) – на 33% (табл. 10).
Таблиця 10. Динаміка показників артрологічного статусу у пацієнтів на фоні вживання ГС
| Показник | До лікування | Через 1,5місяців | ||
| Me | IQR | Me | IQR | |
| ВАШ у спокої, мм (0-100) | 23,50 | 10,00-41,75 | 12,50* | 4,75-28,00 |
| ВАШ при ходьбі, мм(0-100) | 58,00 | 40,75-69,50 | 41,50* | 20,75-51,25 |
| Індекс Лекена, бали (0-25) | 10,50 | 7,00-15,00 | 6,50* | 4,00-9,25 |
| WOMAC (біль), мм (0-500) | 158,00 | 89,00-263,00 | 82,00* | 32,25-155,25 |
| WOMAC(скутість),мм(0-200) | 52,00 | 37,25-103,50 | 24,00* | 15,00-50,50 |
| WOMAC (функціональна активність), мм (0-1700) | 529,00 | 261,00-905,00 | 342,00* | 128,00-637,00 |
| Сумарний індекс WOMAC(0-2400) | 730,50 | 387,25-1195,00 | 462,50* |
170,75-841,50 |
Примітка: * – р<0,001, різниця вважається достовірною при р<0,05.
Під час дослідження не виявлено динаміки таких лабораторних показників, як білірубін, АЛТ, АСТ, креатинін, сечова кислота, глюкоза та ШОЕ, які в більшості пацієнтів до включення у дослідження були в межах норми (табл. 11).
Таблиця 11. Динаміка загальноклінічних показників у хворих на ОА до та після лікування ГС
| Показник | До лікування | Через 1,5 міс | ||
| Me | IQR | Me | IQR | |
| СРБ, мг/л | 6,00 | 4,00-8,40 | 4,00* | 4,00-6,00 |
| ШОЕ, мм/год | 12,00 | 7,75-15,25 | 10,00 | 7,75-12,50 |
| Сечова кислота, мкмоль/л | 408,00 | 317,25-477,50 | 410,50 | 311,50-475,50 |
| Білірубін, мкмоль/л | 16,30 | 10,38-16,80 | 16,20 | 10,85-16,90 |
| АЛТ | 0,18 | 0,11-0,29 | 0,21 | 0,11-0,30 |
| АСТ | 0,24 | 0,14-0,28 | 0,24 | 0,15-0,32 |
| Креатинін, мкмоль/л | 89,00 | 82,00-94,75 | 86,5 | 79,50-98,00 |
| Холестерин, ммоль/л | 5,20 | 4,90-6,23 | 5,20 | 4,70-6,00 |
| Глюкоза, ммоль/л | 5,15 | 4,58-5,40 | 4,80 |
4,60-5,50 |
Примітка: * – р<0,001, різниця вважається достовірною при р<0,05.
IL-1 статистично достовірно знизився з 3,69 (IQR: 2,50–7,59) пг/мл до 2,52 (IQR:1,75–3,94) пг/мл. Зафіксовано достовірне зниження показників СРБ на 29%, що свідчить про протизапальний ефект ГС.
ГС засвідчив позитивний терапевтичний ефект при гонартрозі, але не впливав на рівень сечової кислоти.
Отже, при лікуванні пацієнтів з ОА та гіперурикемією, діацереїн статистично достовірно знижував рівень сечової кислоти, ГС не впливав на її рівень, а ХС – підвищував (малюнок).
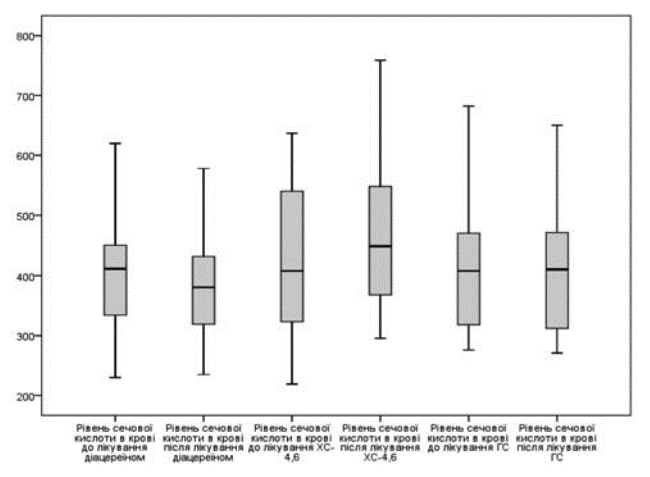 Динаміка рівня сечової кислоти на тлі вживання симптоматичних
Динаміка рівня сечової кислоти на тлі вживання симптоматичних
повільнодіючих протизапальних препаратів
Вплив на гіперурикемію препаратів можливо пов’язаний з їхньою дією на IL-1 , адже IL-1 через активацію інфламасом підвищує загибель клітин (A.E. Denoble, 2011). У даному дослідженні ми отримали зниження рівня IL-1 при застосуванні усіх SYSАDOA, проте більш виражене зниження спостерігалось під час застосуванні діацереїну (власне інгібітору IL-1 ). Так, на тлі вживання діацереїну рівень IL-1 зменшився на 38,3%, ГС – на 31,7%, ХС – на 16,5%. Крім того, під час вживання німесуліду виявлено статистично достовірне зниження рівня IL-1 на 14% на відміну від групи із застосуванням мелоксикаму, що і знайшло відображення у тенденції до зниження (хоча і статистично не достовірній) рівня сечової кислоти.
ВИСНОВКИ
Встановлено, що у 63,63% пацієнтів з ОА виявлено гіперурикемію, яка спричиняла до більш тяжкого перебігу ОА та більш виражених рентгенологічних змін.
У дослідженні було показано, що препаратом вибору для зняття больового синдрому протягом перших 14 днів є німесулід, який є більш ефективний, ніж мелоксикам, а крім того зменшує рівень IL-1 (важливого прозапального фактору). Німесулід, на відміну від мелоксикама, надає більш виражений клінічний ефект, а саме: зменшення вираженості больового синдрому, скутості і функціональних порушень, що, можливо, пов’язано з його коротким механізмом дії (3,2–6 год), у той самий час, як мелоксикам володіє більш пролонгованим механізмом дії (15–20 год). Крім того, вживання німесуліду має тенденцію до зниження рівня сечової кислоти, водночас мелоксикам не впливав на її рівень, що може бути корисним при лікуванні пацієнтів з гіперурикемією.
За наявності гіперурикемії у хворих на ОА застосування діацереїну приводило до зниження рівня сечової кислоти та більшої ефективності порівняно з хондроїтин сульфатом (ХС), у зв’язку з чим діцереїн може бути препаратом вибору у даної групи пацієнтів. Як видно із представлених даних, ХС достовірно підвищує рівень сечової кислоти у хворих на ОА з гіперурикемією, але не підвищує рівень сечової кислоти у хворих з її нормальним вмістом. Глюкозамін сульфат довів позитивний терапевтичний ефект при гонартрозі, проте не впливав на рівень сечової кислоти.
Сведения об авторах
Шуба Неонила Михайловна – Кафедра терапии и ревматологии Национальной медицинской академии последипломного образования им. П.Л. Шупика, 04112, г. Киев, ул. Дорогожицкая, 9
Воронова Татьяна Дмитриевна – Кафедра терапии и ревматологии Национальной медицинской академии последипломного образования им. П.Л. Шупика, Клиническая городская больница №7, 03179, г. Киев, Котельникова, 95
Крылова Анна Сергеевна – Кафедра терапии и ревматологии Национальной медицинской академии последипломного образования им. П.Л. Шупика, 04112, г. Киев, ул. Дорогожицкая, 9; тел.: (050) 384181165; тел.: (044) 224124133
Хамбир Татьяна Сергеевна – Кафедра терапии и ревматологии Национальной медицинской академии последипломного образования им. П.Л. Шупика, 04112, г. Киев, ул. Дорогожицкая, 9
Пилипенко Анастасия Владимировна – Кафедра терапии и ревматологии Национальной медицинская академии последипломного образования им. П.Л. Шупика, 04112, г. Киев, ул. Дорогожицкая, 9
СПИСОК ЛІТЕРАТУРИ
- Алексеева Л.И. Симптоматические препараты замедленного действия при лечении ОА. / Л.И. Алексеева //Consiliummedicus. – 2009. – № 11 (9). – С. 100–104.
- Барскова В.Г., Насонова В.А. Цапина Т.Н. и др. Эффективность и безопасность применения нимесулида (нимесил) у больных подагрическим артритом. Клин мед. – – № 12. – С. 49–54.
- Первичный (возрастзависимый, инволюционный) остеоартроз / В.К. Казимирко, В.Н. Коваленко, В.И. Мальцев. – : Морион, 2006. – 176 с.
- Проценко Г. О. Застосування інгібіторів ІЛ-1 у хворих на подагру та остеоартроз / Г.О. Проценко, Н.С. Бойчук, Т.І. Гавриленко // Український ревматологічний журнал. – – № 2. – С. 75–78.
- Шуба Н.М., Крилова А.С. Ефективність структурно-модифікувальних препаратів у пацієнтів з остеоартрозом і гіперурикемією./ Н.М. Шуба, А.С. Крилова // Ортопедия, травматология и протезирование. – 2015 –№ 4. – С. 69–73.
- Ashton Acton Metabolic disorders: new insights for the healthcare professional / Q. Ashton Acton. //Scholarly Paper. – 2013. – P. 57–58.
- Bruyere O. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) / O. Bruyere, C. Cooper, J.P. Pelletier [et al.]// Semin Arthritis Rheum. – 2014. – Vol. 44 (3). – Р. 253–263.
- Burt H.M. Growth of monosodium urate monohydrate crystals: effect of cartilage and synovial fluid components on in vitro growth rates / H.M. Burt, Y.C. Dutt // Ann Rheum Dis. – 1986. – Vol. 45. – P. 858–864.
- Challa S. Association of hyperuricemia and osteoarthritis knee in costal indian population / S. Challa, M.S. Sudhir, N. Alavalapati, J. Satyaprasad // International Journal of Recent Trends in Science And Technology. – 2013. – Vol. 7 (3). – Р. 129–131.
- Cronstein B.N. The inflammatory process of gout and its treatment / B.N. Cronstein, R. Terkeltaub //Arthritis Res Ther. – 2006. – Vol. 8 (1). – P. 3.
- Denoble A.E. Uric acid is a danger signal of increasing risk for osteoarthritis through inflammasome activation / A.E. Denoble, K.M. Huffman, T.V. Stabler [et al.]// Proc Natl Acad Sci USA. – 2011. – Vol. 108. – Р. 2088–2093.
- Ding X, Zeng C The associations of serum uric acid level and hyperuricemia with knee / X. Ding, C. Zeng //Rheumatol Int. – 2016. – Vol. 36 (4). – Р. 567–73.
- Inokuchi T. Plasma interleukin (IL)18 (interferon-gamma-inducing factor) and other inflammatory cytokines in patients with gouty arthritis and monosodium urate monohydrate crystal-induced secretion of IL-18 / T. Inokuchi, Y. Moriwaki, H. Tsutsui // Cytokine. – 2006. – Vol. 33 (1). – Р. 21–27.
- Klumb E. The treatment of acute gout arthritis. Double-blind randomized comparative study between nimesulid and indomethacin. / E. Klumb //Revista Brasileira De Medicine.– 1996. – Vol. 53. – Р. 540–546.
- Laurent T.C. Solubility of sodium urate in the presence of chondroitin-4- sulphate / T.C. Laurent // Nature. – 1964. – Vol. 202. – P. 1334.
- Martinon F. Gout: new insights into an old disease / F. Martinon, L.H. Glimcher //J Clin Invest. – 2006. – Vol. 116. – P. 2073–2075.
- Plotnikoff R. Osteoarthritis prevalence and modifiable factors: a population study / Plotnikoff // BMC Public Health.– 2015. – Vol. 15. – Р. 1195.
- Sellam J, Berenbaum F. Is osteoarthritis a metabolic disease? / J Sellam, F Berenbaum //Joint Bone Spine. – 2013. – Vol. 80 (6). – Р. 568–73.
- Shaoxian H.U. Diacerein combined with febuxostat relieves symptoms of gout / U. Shaoxian// 2014. – Режим доступу до ресурсу: http://www.clinicaltrials.gov./ct2/show/NCT02060552.htm.
- Sharma L. (2016) Osteoarthritis year in review 2015: / Sharma L. // Osteoarthritis Cartilage. – 2016. – Vol. 24 (1). – Р. 36–48.
- Sun Y. Serum uric acid and patterns of radiographic osteoarthritis – the Ulm osteoarthritis study /Y. Sun, H. Brenner, S. Sauerland [et al.] //Scand J Rheumatol. – 2000. – Vol. 29. – Р. 380–386.
Статья поступила в редакцию 06.06.17
Стаття надана мовою оригіналу






