
 Article
Article
 09.04.2025
09.04.2025
Динамика когнитивных функций, психопатологических проявлений и показателей качества жизни у лиц с алкогольной зависимостью под влиянием препарата Когнум-500*
Маркозова Л.М., Васильева О.А., Лесная Н.Н. Институт неврологии, психиатрии и наркологии НАМН Украины, Харьков, Украина
Резюме
Маркозова Л.М., Васильева О.А., Лесная Н.Н.
Институт неврологии, психиатрии и наркологии НАМН Украины, Харьков, Украина
Исследованы динамика когнитивных функций (КФ), психопатологических проявлений, электрогенез мозга и качество жизни (КЖ) у лиц с алкогольной зависимостью (АЗ) под влиянием лечения по традиционной схеме (I группа) и с использованием Когнума в комплексной терапии (IІ группа). Выявлены позитивная динамика купирования психопатологической симптоматики у лиц обеих групп; высокий уровень показателей КЖ у лиц с АЗ после лечения (p<0,05); зафиксировано восстановление когнитивной продуктивности до уровня условной нормы у 90,9% лиц ІІ группы, улучшение электрогенеза мозга, что подтверждает правильность выбранной терапевтической тактики для лиц IІ группы и эффективность препарата Когнум при коррекции когнитивных нарушений у лиц с АЗ; наличие блока показателей КЖ у лиц IІ группы, которые способствуют активной ресоциализации пациентов. Разработана схема коррекции когнитивных нарушений у лиц с АЗ препаратом Когнум-500.
Ключевые слова: алкогольная зависимость, когнитивные функции, психопатологические проявления, электрогенез мозга, качество жизни, Когнум.
Abstract
Dynamics of cognitive functions, of psychopathology and quality of life in patients with alcohol dependence under the influence of the medication Cognum-500
Markozova L., Vasylieva О., Lisna N.
Institute of Neurology, Psychiatry and Narcology of the National Academy of Medical Sciences of Ukraine, Kharkiv, Ukraine
The dynamics of cognitive functions (CF), psychopathological manifestations, brain electrogenesis and quality of life in patients with alcohol dependence (AD) under the influence of treatment according to the traditional scheme (group I) and with the use of cognum in complex therapy (group II). Positive dynamics of psychopathological symptoms relief in both groups of patients was revealed; high level of quality of life indicators in patients with AD after treatment (p<0.05); fixed recovery of cognitive productivity to the level of the standards in 90.9% of those of group II improved electrogenesis brain that validates the selected therapeutic tactics for individuals of group II and the effectiveness of the medication cognum for correction of cognitive disorders in patients with AD; the indicators of quality of life in persons of group II, which contribute to active re-socialization. The schemes of correction cognitive violations for patients with AD by medication cognum-500 were developed.
Keywords: alcohol dependence, cognitive functions, psychopathological manifestations, brain electrogenesis, quality of life, cognum.
ВВЕДЕНИЕ
На протяжении последнего десятилетия в мире уделяется все больше внимания проблеме деменций и недементным когнитивным расстройствам, которые по распространенности остаются ведущими среди заболеваний головного мозга [1]. По данным европейских эпидемиологических исследований, деменция наблюдается у 6–7% людей после 65 лет. Только заболевание Альцгеймера занимает 2–3-е место по величине затрат на медицинскую и социальную помощь среди неврологических и психических расстройств. Однако чаще встречаются недементные когнитивные расстройства, чем и обусловлена их медицинская и социальная значимость [2]. Некоторая часть деменций имеет соматогенный характер, может быть обусловлена токсическим или ятрогенным влиянием. Когнитивные нарушения определяются у 50–70% лиц с алкогольной зависимостью (АЗ), при этом в 10% случаев они носят выраженный характер, который достигает степени деменции [3, 4]. Среди клинических особенностей данного состояния выделяются нарушения памяти, регуляторных и зрительно-пространственных функций, снижение концентрации внимания, способности к вербальному и невербальному абстрагированию, обучению и т.д. Часто когнитивные нарушения сочетаются с психопатологическими проявлениями, почти у 80% пациентов отмечаются тревога и депрессия той или иной степени выраженности.
Снижение когнитивной продуктивности является одной из главных клинических характеристик АЗ. Известно, что хроническая интоксикация этанолом вызывает поражение практически всех отделов ЦНС и приводит к прогрессирующему ухудшению интеллектуально-мнестических функций [5]. Все эти изменения имеют непосредственное отображение на электрофизиологической активности головного мозга лиц с АЗ. Нейрофизиологические механизмы развития зависимости от алкоголя базируются в стволовых и лимбических структурах мозга, именно в тех участках, где находится система эмоциогенного подкрепления, которая участвует в обеспечении регуляции эмоционального состояния, настроения, мотивационной сферы, психофизического то- нуса, когнитивных процессов, адаптационных реакций и поведения человека в целом [6, 7].
Таким образом, на разных стадиях зависимости наблюдаются раз- личные нарушения когнитивных функций (КФ), которые в дальнейшем могут приводить к более тяжелым церебральным нарушениям и отягощать прогноз. Своевременное выявление когнитивных нарушений на додементных стадиях повышает возможности их лечения и вторичной профилактики деменций. Очевидно, что оценка КФ пациента является необходимой для построения индивидуальной терапевтической схемы и разработки адекватных реабилитационных мероприятий.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить динамику КФ, психопатологической симптоматики, электроэнцефалографических данных, показателей качества жизни (КЖ) у лиц с АЗ и разработать схему их коррекции препаратом Когнум.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось у лиц с АЗ (шифр диагноза F10.2 по МКБ-10) в ГУ «ИНПН НАМН Украины» при наличии письменного информированного согласия на участие в исследовании.
Обследованные лица с АЗ мужского пола (n=22) были распределены на группы в зависимости от схемы лечения. Так, пациенты I группы (n=11) получали традиционную терапию (ТТ) согласно стандартам лечения [8], пациентам II группы (n=11) в схему лечения был включен препарат нейропротекторного действия (Когнум 500 мг дважды в сутки, утром и днем, на протяжении месяца). В качестве стабилизатора настроения у лиц обеих групп в комплексной терапии применяли препарат из группы карбамазепинов (400–600 мг в сутки). Средний возраст пациентов составлял 37,27±1,79 и 36,73±1,83 года соответственно. Доза употребляемого напитка определялась средней суточной дозой алкоголя (СДА) в перерасчете на водку. Одна СДА равняется 40 мл водки.
В работе использованы следующие методы: клинико-анамнестический, психопатологический, электроэнцефалографический, тест AUDIT (The Alcohol Use Disorders Identification Test) [9], шкала CIWA-Ar для определения выраженности синдрома отмены алкоголя (СОА) [10], методика определения психопатологической симптоматики по шкале Derogatis [11], короткая шкала оценки психического статуса MiniMental State Examination (MMSE) [12] с учетом времени выполнения обследованным каждого теста; анкета показателей КЖ J.E. Mezzich et al. [13], методы математической статистики [14].
Исследование электрогенеза головного мозга проведено на 16-канальном электроэнцефалографе с помощью диагностического комплекса «НЕЙРОН-СПЕКТР+2», с локализацией электродов «10–20» в симметричных проекциях: лоб, висок, темя, затылок. Стандартные зоны отведения (и соответствующие электроды) следующие: затылочные (occipitalis – О1 и О2), теменные (parietalis – РЗ и Р4), центральные (centralis – СЗ и С4), лобные (frontalis – F3 и F4), лобные полюсные (polus Fpl і Fp2), нижне-лобные (F7 и F8), височные (temporalis – ТЗ и Т4), задне-височные (Т5 и Т6). Программа исследования включала запись фоновой электроэнцефалограммы (ЭЭГ) до и после лечения пациентов в состоянии покоя и под действием следующих функциональных нагрузок: открыть – закрыть глаза; гипервентиляция 1–3 мин.; влияние ритмичной фотостимуляции. Оценку ЭЭГ проводили визуально и с помощью математического анализа с использованием пакета компьютерных программ, что позволяло провести спектральный анализ
ЭЭГ с построением графиков спектров и рассчитать коэффициенты межполушарной асимметрии. Анализировались 10 с. из эпохи записи с разбивкой по 2 с. Для оценки абсолютной спектральной мощности ЭЭГ выделяли следующие частотные диапазоны: дельта (0,5–4 Гц), тета (4,0–7,0 Гц), альфа (8,0–12,0 Гц), бета (15,0–35,0 Гц) [6, 15–18].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При изучении анамнестических данных выявлено, что наследственность АЗ у лиц IІ группы отягощена в 2,7 раза выше, чем у лиц I группы (72,73% против 27,27%). Выявлено, что по уровню образования среди лиц I группы превалировали лица со средним специальным образованием (47,06%), среди лиц II группы – с высшим (53,85%).
При изучении клинико-анамнестических данных установлено, что первое знакомство с алкоголем в среднем происходило у лиц I и II группы в одном возрасте (15,55±0,47 и 14,18±0,87 года соответственно). Обследованные обеих групп предпочитали водку. СДА у лиц I группы составляла 20,45±2,54, у лиц II группы – 18,98±1,82; по показателям длительности формирования СОА и давности заболевания группы были одинаковыми. Так, длительность формирования СОА у лиц I группы составляла 2,85±0,97 года, у лиц II группы – 3,00±0,50 года; давность заболевания – 8,55±1,73 года и 5,60±1,39 года соответственно. Средний показатель выраженности проявлений СОА до лечения у лиц II группы определялся как тяжелый, у лиц I группы – умеренный (33,18±9,66 и 17,55±1,27 балла по шкале CIWA-Ar соответственно), после лечения про- исходило достоверное уменьшение показателей (0,00±0,00 и 1,64±0,49 балла соответственно) (p<0,05). Амнезия токсичного генеза наблюдалась на протяжении 3,18±0,71 года у лиц I и 1,96±0,80 года у лиц II группы. Эпилептические припадки однократно на высоте СОА в 2 раза чаще наблюдались у лиц II группы (18,18% против 9,9% у лиц I группы). Лечились впервые 45,45% лиц I и 27,27% лиц II группы, неоднократно чаще проходили лечение лица II группы (36,36% против 27,27% I группы).
При изучении проявлений психопатологических нарушений по шкале Derogatis выявлено, что до лечения у лиц II группы отмечался более широкий спектр расстройств. Так, в данной группе дискомфорт наблюдался за счет выраженной тревожно-депрессивной симптоматики с элементами обсессивности-компульсивности, в то время как у лиц I группы – за счет тревожности (рис. 1). После лечения происходило купирование психопатологической симптоматики (рис. 1) у лиц обеих групп (p<0,05).
Динамическая оценка когнитивного статуса проводилась с помощью шкалы MMSE, содержащей ряд тестов, которые позволяют оценить состояние кратковременной и долгосрочной памяти, ориентирования в пространстве и времени, функцию речи, гнозис и праксис. Достоверная разница (p<0,05) между показателями до и после лечения у лиц II группы отмечалась по всем тестам, кроме тестов восприятия, речи, 3-этапной команды и перерисовать рисунок (рис. 2). По времени выполнения наблюдалась достоверная разница при выполнении всех тестов за счет уменьшения времени (p<0,05) (рис. 3). Достоверная разница между показателями у лиц I и II групп после лечения при выполнении тестов отсутствовала по следующим тестам и времени их выполнения:
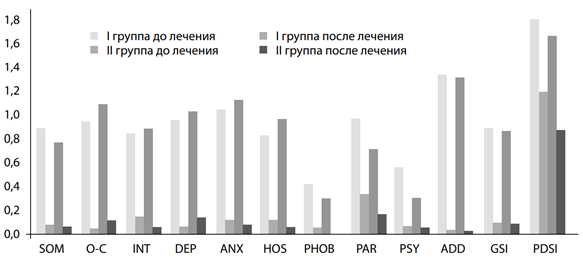
Рис. 1. Средние значения показателей опросника выраженности психопатологической симптоматики по шкале Derogatis (SCL-90 R) у обследованных І и ІІ групп до и после лечения
Примечания: условные обозначения шкал Derogatis: SOM – шкала соматизации; O-C – шкала обсессивности-компульсивности; INT – шкала межличностной сенситивности; DEP – шкала депрессии; ANX – шкала тревожности; HOS – шкала враждебности, агрессивности; PHOB – шкала фобичной тревожности; PAR – шкала паранояльности; PSY – шкала психотизма; ADD – шкала дополнительная; GSI – общий индекс тяжести психического состояния; PDSI – индекс симптоматического дистресса.
«Восприятие», «Речь», «3-этапная команда» и «Чтение» (рис. 2); а также по времени выполнения тестов «Концентрация внимания» и «Память», но по показателям при выполнении остальных тестов, а также времени их выполнения установлена достоверная разница (p<0,05) (рис. 3).
Таким образом, практически при однородности групп до лечения выявлена достоверная разница (p<0,05) у лиц II группы между
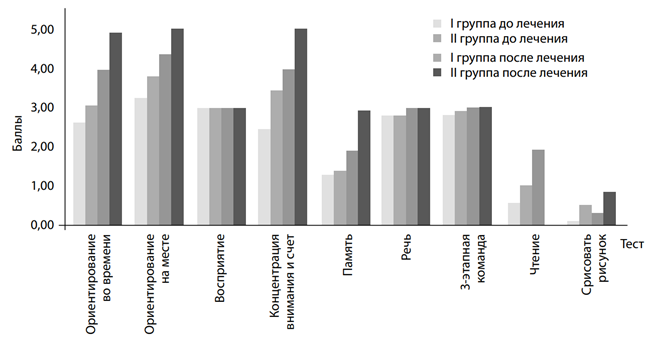
Рис. 2. Среднее количество баллов при выполнении тестов шкалы «Оценка психического статуса» (MMSE) у обследованных І и ІІ групп до и после лечения
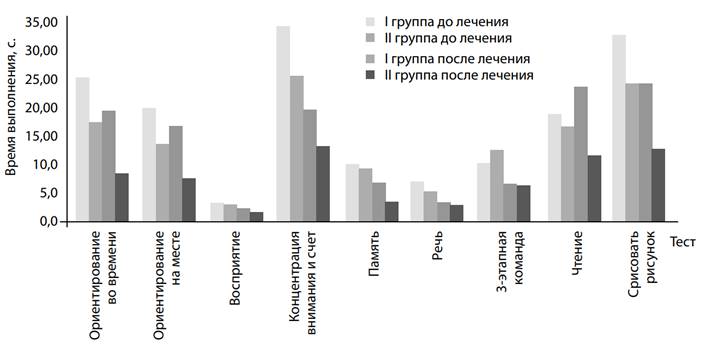
Рис. 3. Время выполнения тестов шкалы «Оценка психического статуса» (MMSE) у обследованных І и ІІ групп до и после лечения
показателями до и после лечения и между показателями лиц I и II групп после лечения за счет более высокого балла при выполнении тестов (21,91±1,12 балла у лиц I группы против 29,55±0,21 балла у лиц II группы) и в 1,9 раза меньшего времени, необходимого для выполнения тестов (128,97±8,97 с. против 68,95±4,91 с. соответственно), что свидетельствует о значительном улучшении всех функций ориентирования (в том числе и пространственного), концентрации внимания и памяти у лиц II группы.
При анализе результатов субтеста «Срисовать рисунок» были получены данные, которые вызвали особенный интерес (рис. 4–6). Так, согласно инструкции, пациентам предлагали скопировать две геометрические фигуры, то есть нарисовать рисунок по образцу. При выполнении данного задания у пациентов І группы как на этапе до лечения (4Б, 5Б), так и после него (4В, 5В) выявили целый ряд нарушений, а именно: трудности вхождения в задание, повышенную импульсивность, что

А Б В
Рис. 4. Выполнение теста «Срисовать рисунок» в динамике лечения пациентом П., 29 лет (I группа)
Примечания: А – контрольный образец рисунка; Б – рисунок обследованного до лечения; В – рисунок обследованного после лечения.

А Б В
Рис. 5. Выполнение теста «Срисовать рисунок» в динамике лечения пациентом Б., 38 лет (I группа)
Примечания: А – контрольный образец рисунка; Б – рисунок обследованного до лечения; В – рисунок обследованного после лечения.
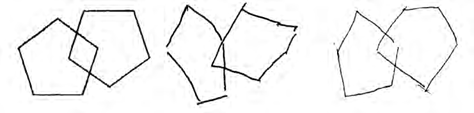
А Б В
Рис. 6. Выполнение теста «Срисовать рисунок» в динамике лечения пациентом Г., 30 лет (II группа)
Примечания: А – контрольный образец рисунка; Б – рисунок обследованного до лечения; В – рисунок обследованного после лечения.
приводило к ошибкам, искажение деталей и пропорций фигур, фрагментарность, дубляж линий, высокий тонус нажима, что свидетельствовало о наличии у этой группы обследованных стойких нарушений пространственного праксиса и зрительно-моторной координации. У пациентов ІІ группы на первом этапе исследования (6Б) также отмечались подобные нарушения, но, как свидетельствуют результаты повторного обследования после лечения (6В), они были более успешно нивелированы.
В целом выявлено, что до лечения у лиц обеих групп отмечались нарушения КФ разной степени выраженности. Несмотря на то, что у лиц І группы когнитивные расстройства умеренной и выраженной степени тяжести наблюдались у преимущественного количества лиц (90,9% против 45,45% у лиц II группы), после лечения ни в одном случае у лиц I группы не про- изошло улучшения КФ до их восстановления, в 18,18% случаев КФ были выражены умеренно, в 9,09% – оставались выраженными (см. таблицу).
Таким образом, согласно интерпретации теста MMSE, для лиц І и ІІ групп была установлена значительная позитивная динамика КФ в ходе проведенного лечения, но при этом у большинства пациентов IІ группы (у 90,9% лиц) было зафиксировано восстановление когнитивной продуктивности до уровня условной нормы (29–30 баллов), чего не наблюдалось среди лиц І группы (см. таблицу), что свидетельствует о более адекватной терапевтической тактике, реализованной во IІ группе пациентов, а также об эффективности препарата Когнум при коррекции когнитивных расстройств у лиц с АЗ.
Результаты оценки когнитивного статуса лиц с АЗ по шкале MMSE в динамике лечения в процентах
| Показатель | І группа, n=11 | ІІ группа, n=11 | ||
| до лечения | после лечения | до лечения | после лечения | |
| Отсутствие когнитивных нарушений (29–30 баллов) | 0,00 | 0,00 | 0,00 | 90,91 |
| Легкие когнитивные нарушения (24–28 баллов) | 9,09 | 72,72 | 54,54 | 9,09 |
| Умеренные когнитивные нарушения (20–23 балла) | 36,36 | 18,18 | 18,18 | 0,00 |
| Выраженные когнитивные нарушения (11–19 баллов) | 54,54 | 9,09 | 27,27 | 0,00 |
| Тяжелая деменция (0–10 баллов) | 0,00 | 0,00 | 0,00 | 0,00 |
При изучении и обобщенном сравнительном анализе типов ЭЭГ обследованных с АЗ по визуальной классификации Жирмунской Е.А. [19] и данных автоматического амплитудно-частотного картирования биоэлектрической активности по регионам мозга были получены следующие данные. Варианты нормальной ЭЭГ практически не встречались. У всех лиц І группы биоэлектрическая активность имела вид так называемых плоских ЭЭГ, соответствующих II и III типу по классификации Жирмунской Е.А. [19], из которых в 81,81% случаев наблюдались электро- энцефалограммы с доминированием β-ритма на фоне патологически измененного низкоамплитудного α-ритма от 10–20 мкВ в передних и до 40–50 мкВ в задних отведениях, региональные особенности сглажены, отмечались отдельные волны θ-диапазона амплитудой до 40–60 мкВ и колебания по типу острая – медленная волна в затылочных и височных отведениях (рис. 7).
При проведении частотной фотостимуляции реактивность была сниженной или практически отсутствовала, после гипервентиляции у части пациентов было отмечено некоторое увеличение амплитуды патологической активности с появлением также одиночных медлен- но-волновых компонентов либо паттернов β-ритма в лобно-теменных отведениях.
Патологические изменения биоэлектрической активности мозга у пациентов ІІ группы до лечения преимущественно проявлялись стертыми региональными отличиями, четкой дизритмией, когда α-ритм низ- кой амплитуды (до 20–30 мкВ) перемежался с высокочастотной и низко- амплитудной β-активностью (10–20 мкВ) с включением одиночных мед- ленных волн диффузно по разным отведениям либо локально (чаще по лобно-височным регионам или теменно-затылочным отведениям, II и III типа по классификации Жирмунской Е.А. [19]).
В 72,72% случаев фоновая ЭЭГ характеризовалась альфа-ритмом со сниженной амплитудой от 25 до 40 мкВ, который сочетался с бета- ритмом (с индексом альфа-волн меньше 50%), участками тета-волн до 60 мкВ и одиночных d-колебаний в передних, центральных и затылочных областях (рис. 8).
У 18,18% лиц І группы и у 27,27% лиц ІІ группы на фоновой записи регистрировался IV тип по Жирмунской Е.А. [19], который
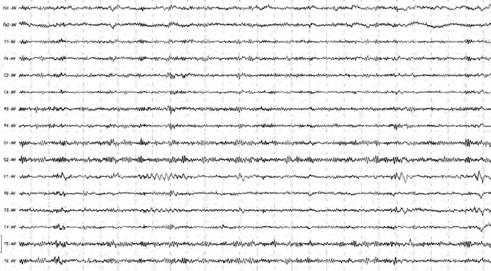
Рис. 7. Пример ЭЭГ до лечения пациента П., 38 лет (І группа)
характеризовался дезорганизованной биоэлектрической активностью с недостаточно регулярной α-активностью довольно высокой (120–150 мкВ) амплитуды, с β-активностью высокой частоты и увеличенной амплитудой, усиленной по всем областям, также регистрировались паттерны тета- и дельта-волн с очень высокой амплитудой (200–250 мкВ) преимущественно в передних отведениях (лобные и центральные) и в височных регионах билатерально или преимущественно в правой
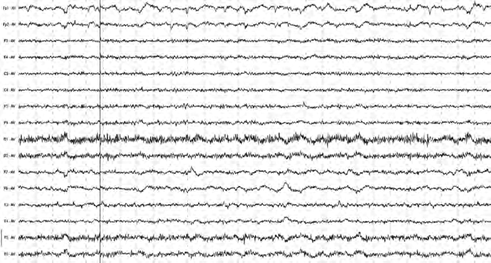
Рис. 8. Пример ЭЭГ до лечения пациента Н., 37 лет (ІІ группа)
гемисфере, что свидетельствовало о судорожной готовности, которая повышалась после функциональных нагрузок. Доминирование низкоамплитудных ритмов с высокой частотой (например, бета-1 и бета-2) свидетельствует о раздражении (ирритации) неспецифических диэнцефальных структур мозга. Это может быть связано с разными нарушениями, а именно: хроническая недостаточность церебрального кровообращения и гипоксия головного мозга на фоне токсического влияния алкоголя, повышенное внутричерепное давление у лиц с АЗ.
Общие показатели биоэлектрической активности лиц с АЗ обеих групп до лечения, по нашим данным и данным других исследователей, свидетельствовали о патологических изменениях в электрогенезе мозга, которые отображали низкую его функциональную активность [7, 16], что коррелировало с проявлениями астеничного и психорганического симптомокомплекса со значительными нарушениями КФ.
После лечения у лиц І группы по данным ЭЭГ не было отмечено значительной динамики. Сохранялась уплощенная электрическая активность во всех структурах за исключением лобных отделов, в лобных же отделах имела место десинхронизация биопотенциалов (преимущественно β-ритма), в височных отделах регистрировалась смешанная активность с добавлением медленных волн, в теменных отделах – подавление доминирующего α-ритма, в затылочных – α- и β-пароксизмы (рис. 9).
После лечения практически у всех пациентов ІІ группы (81,81%) по данным ЭЭГ отмечалось общее улучшение электрогенеза головного мозга, только у двух обследованных биоэлектрическая картина оставалась прежней. По мере улучшения клинического состояния у пациентов ІІ группы наблюдалась нормализация электрической активности. Постепенно появлялся более модулированный альфа-ритм с сохраненной низкой и средней амплитудой, но одновременно нередко оставались
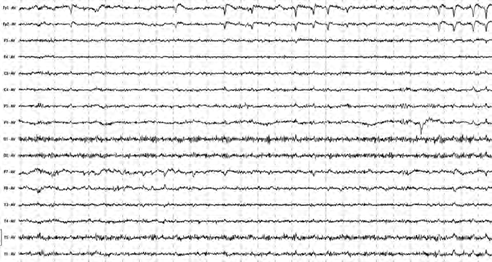
Рис. 9. Пример ЭЭГ после лечения пациента П., 38 лет (І группа)
патологические элементы (медленные волны в лобных, височных и теменных отведениях); периодически возникали пароксизмальные изменения ритмов. Быстрочастотный и высокоамплитудный бета-ритм в 75% случаев постепенно изменялся в сторону снижения частоты, амплитуды и представленности. Далее наблюдалось восстановление региональных различий. В лобной и затылочной областях у лиц ІІ группы динамика электрической активности значительно отличалась к лучшему от вышеописанных данных относительно лиц І группы (рис. 10).
Таким образом, анализ биоэлектрической активности у обследованных обеих групп показал, что при хронической алкоголизации у лиц с АЗ возникают нарушения активирующей неспецифической системы ствола мозга (ретикулярной формации и гипоталамуса), вследствие чего происходит усиление генерирования частот бета-диапазона и пароксизмальной активности, а также нарастание корковых и внутренних атрофий головного мозга, возникает и прогрессирует диффузное аксональное повреждение и стойкое нарушение таламо-кортикальных связей, что приводит к значительным эмоциональным и когнитивным на- рушениям и расстройствам адаптации. После лечения у лиц ІІ группы по данным ЭЭГ выявлено улучшение электрогенеза головного мозга, что коррелировало с улучшением клинического, психоневрологического состояния и КФ. Для пациентов І группы после лечения были характерны более стойкие нарушения базисных состояний функциональной активности мозга и КФ.
При изучении КЖ выявлено, что выраженность показателей у лиц обеих групп до лечения была одинаковой (рис. 11). Наиболее низкие значения показателей КЖ до лечения у лиц обеих групп были по следующим показателям: физического и психологического благополучия, трудоспособности, самореализации, а также общего восприятия КЖ. После
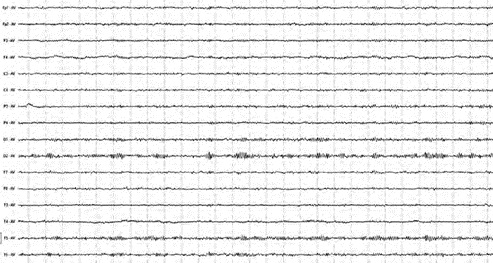
Рис. 10. Пример ЭЭГ после лечения пациента Н., 37 лет (ІІ группа)
лечения значения показателей КЖ отображали улучшение состояния пациентов обеих групп по сравнению со значениями показателей до лечения (p<0,05). Достоверные значения показателей повышения КЖ между лицами II и I групп (рис. 7) наблюдались по межличностному взаимодействию (9,73±0,14 балла против 8,00±0,71), самообслуживанию и независимостью в действиях (9,73±0,19 балла против 8,45±0,51), психо- логическому благополучию (9,45±0,31 балла против 7,91±0,59), духов- ной реализации (9,09±0,39 балла против 7,27±0,74), общему восприятию КЖ (8,91±0,48 балла против 7,82±0,67), общественной и служебной поддержке (8,55±0,41 балла против 6,55±0,86) и общей сумме баллов (91,64±2,19 балла против 77,09±5,44). Таким образом, у лиц II группы установлен блок показателей КЖ (межличностное взаимодействие, самообслуживание и независимость в действиях, психологическое благополучие, духовная реализация, общественная и служебная поддержка и общее восприятие КЖ), который указывает на достаточные адаптивные возможности у лиц II группы и более активную их ресоциализацию. Необходимо отметить, что у 18,18% лиц ІІ группы на 3–4-й день приема Когнума выявлены одиночные высыпания на коже верхних конечностей аллергического генеза. Однако пациенты успели почувствовать улучшение состояния, в связи с чем настаивали на продолжении лечения препаратом Когнум. Им назначался препарат десенсибилизирующего действия (лоратадин 10 мг 1 таблетка на ночь № 3–5), что позволило пациентам пройти полный курс лечения Когнумом. Именно у этих пациентов на фоне значительного улучшения клинико-психопатологического состояния и КФ биоэлектрическая картина оставалась прежней.
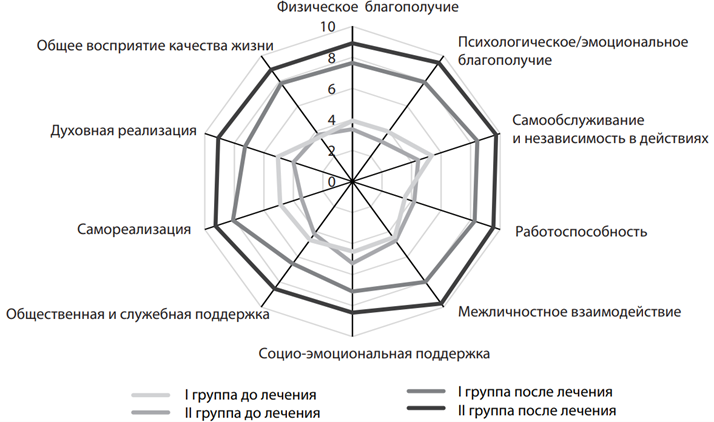
Рис. 11. Показатели качества жизни по опроснику «Показатель качества жизни» Mezzich et al. у обследованных І и ІІ групп до и после лечения
ВЫВОДЫ
Установлено, что по возрасту первого знакомства с алкоголем, давности формирования и выраженности СОА до лечения, длительности болезни группы обследованных были однородными.
Выявлены клинико-анамнестические показатели, которые способствовали развитию когнитивного дефицита у лиц с АЗ: наследственность АЗ (в 2,7 раза выше у лиц ІІ группы), уровень образования (среди лиц I группы было в 3 раза меньше лиц с высшим образованием, в 6,1 раза больше лиц со средним специальным образованием); амнезия токсического генеза (в 1,6 раза была более длительной у лиц I группы), эпилептические припадки на высоте СОА (в 2 раза чаще у лиц II группы); неоднократное лечение (в 1,34 раза чаще у лиц II группы).
Установлены особенности психопатологических нарушений у обследованных в динамике лечения: до лечения у лиц II группы отмечался психопатологический дискомфорт за счет выраженной тревожно-депрессивной симптоматики с элементами обсессивности-компульсивности, у лиц I группы – за счет тревожности. После лечения происходило купирование психопатологической симптоматики у лиц обеих групп (p<0,05).
Выявлено, что до лечения у лиц обеих групп отмечались нарушения КФ разной степени выраженности. В ходе проведенного лечения Когнумом-500 установлена значительная позитивная динамика КФ у лиц ІІ группы: восстановление когнитивной продуктивности до уровня условной нормы (90,9%), значительное улучшение всех функций ориентирования, концентрации внимания и памяти за счет наиболее высокого балла при выполнении тестов и в 1,9 раза меньшего времени, необходимого для выполнения тестов, после лечения (p<0,05), что подтверждает правильность выбранной терапевтической тактики для лиц IІ группы, а также эффективность препарата Когнум при коррекции когнитивных расстройств у лиц с АЗ.
Выявлено, что общие показатели биоэлектрической активности лиц с АЗ обеих групп до лечения свидетельствовали о патологических изменениях в электрогенезе мозга, которые отображали низкую его функциональную активность, что коррелировало с проявлениями астенического и психоорганического симптомокомплекса со значительными нарушениями КФ. После лечения по данным ЭЭГ у лиц І группы не было отмечено значительной динамики, в то время как практически у всех лиц ІІ группы (81,81%) отмечалось общее улучшение электрогенеза головного мозга.
Выявлено, что выраженность показателей по шкале КЖ у лиц обеих групп до лечения была одинаковой; после лечения Когнумом-500 у лиц II группы установлен блок показателей КЖ, который способствует формированию определенных адаптивных возможностей у лиц этой группы и более активной их ресоциализации по сравнению с лицами I группы.
Таким образом, препарат Когнум-500 является эффективным препаратом ноотропного действия при лечении когнитивных расстройств у лиц с АЗ, позитивная динамика определена даже после одномесячного курса лечения; выявлено позитивное взаимодействие Когнума-500 с препаратами из группы карбамазепинов; прием Когнума-500 не вызывал ухудшения электрогенеза мозга или усиления фокальной симптоматики, кроме того, в 81,81% случаев выявлено улучшение электро- генеза мозга, а в 90,9% случаев – восстановление когнитивной продуктивности до уровня условной нормы; значительное улучшение КЖ, адаптивных возможностей и ресоциализации лиц с АЗ II группы является основанием рекомендовать прием Когнума-500 2 раза в сутки (утром и днем) на протяжении 2 месяцев.
ЛИТЕРАТУРА
- Cummings J. et al. (2016) Drug development in Alzheimer`s disease: the path to 2025. Alzheimer`s Research & Therapy, 8: 39.
- Yahno N., Zaharov V., Lokshina A., Koberskaya N., Mhitaryan E. (2011) Dementsii: rukovodstvo dlya vrachei. 3-e izd [Dementia: a guide for doctors. 3rd ed]. M.: MEDprecs-inform, 272 p.
- Miller L. (1991) Predicting relapse and recovery in alcoholism and addiction: neuropsychology, personality, and cognitive style. J Subst Abuse Treat., vol. 8 (4), pp. 277–291.
- Parsons O.A. (1994) Neuropsychological measures and event-related potentials in alcoholics: interrelationships, long-term reliabilities, and prediction of resumption of drinking. J Clin Psychology, 50 (1), pp. 37–46.
- Adrianova E. (2013) Kognitivnie rasstroistva pri alkogolizme [Cognitive impairment in alcoholism]. Narkologiya, 2, pp. 79–85.
- Boldireva G. (2000) Elektricheskaya aktivnost’ mozga cheloveka pri porazhenii dientsefal’nih i limbicheskih struktur [Electrical activity of the human brain in the defeat of diencephalic and limbic structures]. M.: «Nauka», MIAK, «Nauka/Interperiodika», 182 p.
- Vorob’eva, T., Paikova L., Filimonova N. (2009) Osobennosti psihofiziologicheskogo sostoyaniya u lits s vlecheniem k alkogolyu i narkotikam [Features of psychophysiological state in persons with an attraction to alcohol and drugs]. Psihicheskoe zdorov’e, 2, pp. 43–48.
- Vієvs’kii A., Sosіn І., Vієvs’kii A. Protokoli nadannya medichnoї narkologіchnoї dopomogi [elektronnii resurs].Standarti nadannya medichnoї dopomogi v Ukraїnі. Available at: //http://medstandart.net/browse/3277
- Babor T.F., Higgins-Biddle J.C., Saunders J.B. (2001) AUDIT – The Alcohol Use Disorders Identification Test. Guidelines for Use in Primary Care Second Edition. World Health Organization. Department of Mental Health and Substance Dependence, 99 p.
- Sullivan J.T., Sykora K., et al. (1989) Assessment of alcohol withdrawal: The revised clinical institute withdrawal as- sessment for alcohol scale (CIWA-Ar). Br J Addiction., 89, pp. 1353–1357.
- Derogatis L.R., Lipman R.S., Covi L. (1973) SCL–90: An outpatient psychiatric rating scale. Preliminary report. Psycho- pharmacology Bulletin, vol. 9, no 1, pp. 13–27.
- Mironova E. (2005) Sbornik psihologicheskih testov: posobie [Collection of psychological tests: manual]. : Zhenskii institut ENVILA, 155 p.
- Mezzich J.E., Cohen N., Liu J. (1999) Validization an efficient quality life index. Abstracts book of XI World Congress of Psychiatry “Psychiatry on new Thresholds”. Hamburg, pp. 427–428.
- Gubler E. (1978) Vichislitel’nie metodi analiza i raspoznavaniya patologicheskih protsessov [Computational methods of analysis and recognition of pathological processes]. : Meditsina, 294 p.
- Vorob’eva T., Paikova L., Filimonova N. (2009) Osobennosti psihofiziologicheskogo sostoyaniya u lits s vlecheniem k alkogolyu i narkotikam [Features of psychophysiological state in persons with an attraction to alcohol and drugs]. Psihicheskoe zdorov’e, 2, pp. 43–48.
- Zenkov L. (2011) Klinicheskaya elektroentsefalografiya (s elementami epileptologii). 4-e izd. [Clinical electroencepha- lography (with elements of epileptology). 4th ed.]. M.: MEDpress-inform, 368 p.
- Zenkov L., Ronkin M. (1997) Funktsional’naya diagnostika nervnih boleznei: (Rukovodstvo dlya vrachei). 2-e izd. pererab. i dop. [Functional diagnostics of nervous diseases: (Manual for doctors). 2nd ed. pererab. I DOP.]. M.: Meditsina, 640 p.
- Karlov V., Gnezditskii V., Kudryavtseva S. (2010) Paroksizmal’naya aktivnost’ i narushenie kachestva vegetativnoi regulyatsii v patogeneze paroksizmal’nih sostoyanii [Paroxysmal activity and impaired quality of vegetative regula- tion in the pathogenesis of paroxysmal States]. Nervnie bolezni «Aktual’nie voprosi nevrologii», 2, pp. 2–6.
- Zhirmunskaya E. (1991) Klinicheskaya elektroentsefalografiya [Clinical electroencephalography]. : MEIBI, 118 p.
Стаття надана мовою оригіналу






