
 Article
Article
 22.04.2025
22.04.2025
Больовий синдром, маркери кісткового метаболізму у хворих на остеоартроз, підходи до медикаментозної терапії та вплив ожиріння
О.В. Курята, Г.В. Черкасова ДЗ «Дніпропетровська медична академія МОЗ України».
Мета дослідження: оцінити характер больового синдрому у хворих на остеоартроз, вплив ожиріння на клінічну ефективність лікування остеоартрозу (ОА) та динаміку маркерів кісткового метаболізму.
Матеріали та методи. У дослідженні взяли участь 150 хворих на ОА, які на третьому етапі були розподілені на дві групи згідно зі схемою лікування. Пацієнти основної групи (n=15) отримували діацереїн (препарат Флекцерин, ПАТ«Київський вітамінний завод»), групи контролю (n=17) – виключно нестероїдні протизапальні засоби (НПЗЗ).
Результати. Поширеність нейропатичного компонента болю серед хворих на ОА склала 64,7%, використовували НПЗЗ 80,7% паціцєнтів. Ожиріння у хворих на ОА асоціювалося із достовірно більш високим рівнем болю у колінних суглобах та достовірно більш високим ступенем рухових обмежень за індексом WOMAC. У ході дослідження було продемонстровано прямий помірний кореляційний зв’язок (R=0,49; р=0,04) між рівнями РІСР та вираженістю больового синдрому під час фізичного навантаження з боку суглобів кистей та кульшових суглобів.
Терапія діацереїном протягом 3 міс сприяла достовірному зниженню інтенсивності больового синдрому у всіх суглобових зонах при достовірному аналгетичному ефекті лише з боку колінних суглобів при використанні виключно НПЗЗ. Наявність ожиріння у хворих на ОА стало причиною достовірного зниження клінічної ефективності терапії щодо покращення функціонального стану суглобів.
Заключення. Нейропатичний біль є досить поширеним серед хворих на ОА, що асоціюється як із недостатньою обізнаністю пацієнтів щодо можливих ризиків при використані НПЗЗ.
Медикаментозне лікування діацереїном (препарат Флекцерин) зумовило стабільність рівня остеокальцину у разі пріоритетних змін його рівня на тлі ізольованого використання НПЗЗ. Використання діацереїну має додаткові позитивні ефекти щодо зональної поширеності аналгетичного ефекту та покращення функціонального стану суглобів.
Ожиріння у хворих на ОА асоціювалося із достовірним підвищенням інтенсивності больового синдрому з боку колінних суглобів та вищим ступенем рухових обмежень, зумовлюючи разом з тим зниження клінічної ефективності терапії щодо досягнення аналгетичного ефекту та покращення функціональної здатності суглобів.
Ключові слова: остеоартроз, модифікуючі препарати уповільненої дії, діацереїн, флекцерін, остеоартроз та ожиріння, маркери кісткового метаболізму, карбокси- термінальний пропептид проколлагену 1 типу (PICP), остео- кальцин, нейропатичний біль.
Болевой синдром, маркеры костного метаболизма у пациентов с остеоартрозом, подходы к медикаментозной терапии и влияние ожирения
А.В. Курята, А.В. Черкасова
Цель исследования: оценить характер болевого синдрома у пациентов с остеоартрозом (ОА), влияние ожирения на клиническую эффективность лечения ОА и динамику маркеров костного метаболизма.
Материалы и методы. В исследовании участвовали 150 пациентов с ОА, которые на третьем этапе были разделены на две группы в соответствии со схемой лечения. Пациенты основной группы (n=15) получали диацереин (препарат Флекцерин, ПАО «Киевский витаминный завод»), контрольной группы (n=17) – исключительно нестероидные противовоспалительные препараты (НПВП).
Результаты. Частота встречаемости нейропатического компонента боли среди пациентов с ОА составила 64,7%, распространенность использования НПВП среди которых составила 80,7%. Ожирение у пациентов с ОА ассоциировалось с достоверно более высоким уровнем боли в коленных суставах и более высокой степенью двигательных нарушений. В ходе исследования была продемонстрирована прямая корреляционная связь (R=0,49; р=0,04) между уровнями РICP и выраженностью болевого синдрома при физической нагрузке со стороны суставов кистей и тазобедренных суставов.
Терапия диацереином в течение 3 мес способствовала достоверному снижению интенсивности болевого синдрома всех суставных зон в отличии от изолированного использования НПВП, где достоверный аналгетический эффект был продемонстрирован только со стороны коленных суставов. Ожирение у пациентов с ОА приводило к достоверному снижению клинической эффективности терапии в отношении улучшения функционального состояния суставов.
Заключение. Нейропатическая боль достаточно часто встречается среди пациентов с ОА и ассоциируется с недостаточной осведомленностью пациентов в отношении потенциальных рисков при использовании НПВП.
Терапия диацереином (препарат Флекцерин, ПАО «Киевский витаминный завод») обуславливала стабильность уровня остеокальцина при наличии приоритетных изменений его уровня на фоне изолированного использования НПВП. Использование диацереина ассоциировали с дополнительными положительными эффектами в отношении распространенности аналгетического эффекта по суставным зонам и улучшения функционального состояния суставов.
Ключевые слова: остеоартроз, модифицирующие препараты замед- ленного действия, диацереин, флекцерин, остеоартроз и ожирение, маркеры костного метаболизма, карбокситерминальный пропептид проколлагена 1 типа (PICP), остеокальцин, нейропатическая боль.
Pain syndrome, markers of bone metabolism in patients with osteoarthritis, approaches to drug therapy and the impact of obesity
А.V. Kuryata , G.V. Cherkasova
The objective: to assess the nature of pain in patients with osteoarthritis, the impact of obesity on the clinical efficacy of treatment of osteoarthritis (OA) and dynamics of bone metabolism markers.
Patients and methods. The research included 150 patients with OA, who were divided into two groups, according to the receiving therapy. Patients of the main group – received diacerein (drug «Flexirin» PC «Kyiv Vitamin Factory») and patients of control group – received only nonsteroidal anti-inflammatory drugs (NSAIDs).
Results. The prevalence of neuropathic pain component in patients with OA was 64,7%, among which 80,7% use NSAIDs as an analgesic therapy. Obesity in patients with OA was associated with significantly higher levels of pain from the side of knee joints and higher degree of stiffness according to WOMAC index. The results of the study demonstrated a direct moderate correlation (R = 0,49; p = 0,04) between PICP level and the severity of pain at physical load from the side of hands and hip joints.
The therapy by diacerein within 3 months resulted in a reliable decrease of pain syndrome intensity from the side of all articular zones, unlike to isolated NSAIDs use, where a reliable analgesic effect was demonstrated only from the side of knee joints. Obesity in patients with OA led to a significant decrease in clinical efficacy of therapy in point of functional status of the joints.
Conclusions. Neuropathic pain is quite common among patients with OA, which at the same time is associated with the lack of patient’s awareness about possible risks during NSAID’s use.
Medical treatment by diacerein (drug “Flexirin”) causes stability of osteocalcin level, in contrast to the isolated NSAIDs use, where priority changes have been demonstrated against osteocalcin level decrease. The use of diacerein also resulted to additional positive effects from the side of zonal prevalence of analgesic effect and improving of functional ability of joints.
Obesity in patients with OA was associated with a reliable increase of pain level intensity from the side of knee joints and the higher degree of functional limitation, causing at the same time, reduction of clinical efficacy of therapy in point of achieving analgesic effect and improving functional ability of joints.
Key words: osteoarthritis, symptomatic slow acting drugs for OA (SYSADOA), diacerein, flexerin, osteoarthritis and obesity, markers of bone metabolism, procollagen type-I C-terminal propeptide (PICP), osteocalcin, neuropathic pain.
Тривалий час вважали, що причиною больового синдрому при хронічних захворюваннях суглобів, у тому числі при остеоартриті (ОА), є запальні та дегенеративні зміни в уражених суглобах, що зумовлювало модель сугубо ноцицептивного характеру болю, джерелом якого при ОА є насамперед синовіальна оболонка, кістка та м’які тканини (м’язи та периартикулярні тканини). Сучасні дані демонструють, що периферійна сенситизація, яка полягає у непропорційно інтенсивному збудженні периферійних ноцицепторів та призводить до надчутливості аферентних нервів як до звичайних, так і до надмірних рухів у суглобах, є додатковим фактором виникнення болю при артриті [8]. Згідно даної моделі, інтенсивність больового синдрому у хворих з ревматологічною патологією суглобів повинна перш за все корелювати та відповідати рентгенологічній стадії захворювання. Однак, як було доведено у низці робіт, рентгенологічна стадія ОА не завжди відповідає вираженості больового синдрому та ступеню непрацездатності хворих [1]. У рамки ноцицептивної моделі болю також не вкладається наявність зон вторинної гіпералгезії та змін поверхневої чутливості у позасуглобових ділянках тіла у хворих із хронічними захворюваннями суглобів [10]. Таким чином, на сьогоднішній день неможливо провести чітку межу між ноцицептивним та нейропатичним болем у хворих з ОА, оскільки низка клініко-експериментальних досліджень у цій галузі продемонструвала активну роль нейрогенних механізмів у формуванні ревматичного болю та наявність значного нейропатичного компонента болю у хворих з хронічними захворюваннями суглобів, зокрема при ОА [7, 9, 18].
Парадигмою лікування ОА є перш за все зменшення інтенсивності больового синдрому та поліпшення функціональної здатності суглобів, що спрямовано на обмеження прогресування захворювання і поліпшення якості життя хворих. Ведучими організаціями у розробленні рекомендацій лікування хворих на ОА є Європейська антиревматична ліга (EULAR) [17], Американська колегія ревматологів (ACR) [19] та Міжнародне наукове товариство з вивчення остеоартрозу (OARSI) [22]. Відсутність унітарного підходу щодо лікування ОА зумовлює потребу у регулярних переглядах клінічних настанов та рекомендацій щодо ведення таких хворих. На сьогодні актуальними вважають рекомендації OARSI 2014 року, основною відмінністю яких є етапність медикаментозної терапії, тобто розподіл лікувальної тактики на певні кроки у відповідності до доцільності їхнього використання при ініціації лікування ОА. Так, якщо у минулих рекомендаціях EULAR 2013 року використання базових препаратів при остеоартрозі – симптоматичні повільнодіючі препарати (SYSADOA – Symptomatic slow acting drugs for OA) та симптоматичні препарати швидкої дії (нестероїдні протизапальні засоби) вважали рівноцінним без надання переваги одному з наведених вище класів препаратів ініціації лікування ОА, то у сучасних рекомендаціях OARSI акцент зроблено на зміну пріоритетів, де наголошується на тому, що саме симптоматичні повільнодіючі препарати повинні бути ініціальною ланкою у медикаментозному лікуванні ОА.
Саме тому даний клас препаратів, поряд із комплексом немедикаментозних заходів, віднесено до першого кроку терапії ОА. Представником групи препаратів SYSADOA є діацереїн, який продемонстрував добру клінічну ефективність у лікуванні хворих на ОА [4, 5] за рахунок доведеного протизапального ефекту, що зумовлений інгібуванням інтерлейкину-1 та згідно з результатами нещодавніх досліджень спроможний чинити вплив на окремі катаболічні та анаболічні медіатори запалення, які беруть участь у патогенезі ОА [12]. Використання НПЗЗ у той самий час віднесено до другого кроку, що може бути зумовлено високим ризиком виникнення побічних ефектів на тлі використання препаратів даної групи, про що свідчать результати рандомізованих клінічних досліджень.
На жаль, у межах України НПЗЗ відносять до безрецептурних препаратів, поширеність використання яких зростає з року в рік. Основною причиною використання НПЗЗ хворими на ОА є боротьба з больовим синдромом, але залежно від того, який компонент болю домінує у конкретного хворого (ноцицептивний або нейропатичний), ефект від використання НПЗЗ може бути різним і не завжди відповідати очікуванням хворих.
Таким чином, вплив на суглобовий синдром при ОА залишається складною проблемою, що зумовлює достатньо високий відсоток хронізації та персистенції больового синдрому серед хворих на ОА (близько 20% хворих не отримують адекватного лікування хронічного больового синдрому) [3]. Разом з тим, є дані щодо істотного впливу хронічного больового синдрому на тривалість життя хворих. Доведено, що наявність хронічного болю приводить до скорочення тривалості життя жінок у середньому на 10–12 років, а інтенсивність болю у літніх людей більшою мірою впливає на тривалість життя, ніж наявність супутніх захворювань, які потенційно загрожують життю [11].
Незважаючи на цілу низку досліджень з вивчення біомаркерів, які потенційно можна було б використовувати з позицій діагностичної значущості при ОА, питання чіткого «маркерного алгоритму» й досі залишається відкритим [23]. Останні рекомендації з цього питання були викладені у рекомендаціях ESCEO (The European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis) у 2012 році, згідно з якими найбільш достовірними маркерами ОА є структурні молекули або їхні фрагменти, що є складовими компонентами суглобового хряща, субхондральної кістки (СХК) або синовіальної оболонки та, на думку експертів, можуть достовірно відображати процеси деградації та синтезу у цих тканинах [21].
Так, остеокальцин (ОК) є основним неколагеновим білком кісткового матриксу, який містить гідроксиапатит і стає структурним компонентом органічного матриксу кістки [21]. Відомо, що ОК синтезується остеобластами, тому за його рівнем у плазмі крові можна опосередковано судити про метаболічну активність остеобластів, оскільки концентрація ОК у крові – результат нового синтезу, а не вивільнення його при резорбції кісткової тканини. Разом з тим, ОК має кальційзв’язувальну дію та бере участь у мінералізації кістки [2]. Низкою досліджень продемонстровано підвищення рівня ОК у пацієнтів з ОА на тлі активації процесів ремоделювання та якісних змін процесу мінералізації кісткової тканини, що асоціювалося із подальшим прогресуванням остеофітозу [13, 16]. Таким чином, ОК можна розглядати як специфічний маркер функціональної активності остеобластів СХК та чутливий маркер ремоделювання кісткової тканини [14]. Цікавими водночас є дані, що демонструють зниження рівня ОК серед пацієнтів із ожирінням та його зв’язок із порушенням вуглеводного обміну [20].
Поряд із ОК є також низка інших маркерів кісткового метаболізму, які відображають процеси синтезу у кістковій тканині. Наприклад, карбокситермінальний пропептид проколагену 1 типу (PICP), який синтезується остеобластами у вигляді попередника та являє собою велику молекулу, що має на С-кінці частково глобулярний фрагмент – РІСР, структура якого стабілізована бісульфідними зв’язками [15]. Потрапляючи у екстрацелюлярний простір, РІСР зазнає ферментативного гідролізу й залишається у екстрацелюлярній рідині, а зріла молекула колагену 1 типу приймає участь у подальшому формуванні кісткового матриксу. Оскільки співвідношення між кількістю колагену, що відкладається у кістковий матрикс та кількістю РІСР, що потрапляє у кров’яне русло, теоретично дорівнює 1, рівень РІСР можна використовувати для оцінювання метаболічної активності остеобластів [6].
Більшість досліджень з вивчення РІСР зосереджена на вивченні даного маркера з позицій системного остеопорозу, де продемонстровано зниження його рівня в умовах наявності у хворих остеопорозу. Оскільки остеопороз сам по собі приводить до структурних змін у СХК, формуючи тим самим сприятливий плацдарм для розвитку та прогресування ОА, у клінічній практиці нерідко зустрічається поєднаний перебіг цих двох патологічних станів. Враховуючи це, вивчення рівня РІСР у контексті ОА є досить актуальним напрямком сучасної медицини, однак літературних даних щодо вивчення даного маркеру з позицій ОА на сьогоднішній день недостатньо, що й зумовлює актуальність даної роботи.
Інструментом підвищення ефективності лікування хворих на ОА повинна бути персоніфікація лікування, заснована не лише на правильній оцінці джерела болю в ураженому суглобі (ноцицептивний або нейропатичний біль), ступеню структурних змін та функціональної здатності суглобів, наявності запалення, а й в індивідуальному оцінюванні пацієнта: супутня коморбідна патологія, обізнаність хворого про власне захворювання та його лікування, якість життя та рівень больової чутливості пацієнта.
Мета дослідження: оцінити характер больового синдрому у хворих на остеоартроз, вплив ожиріння на клінічну ефективність лікування ОА та динаміку маркерів кісткового метаболізму.
МАТЕРІАЛИ ТА МЕТОДИ
Дослідження проводили на базі ревматологічного відділення КЗ «Дніпропетровська обласна клінічна лікарня імені І.І. Мечникова» та КЗ «Дніпропетровська обласна консультативна поліклініка» після отримання інформованої згоди пацієнтів у відповідності до Гельсінської декларації. У дослідженні взяли участь 150 хворих на ОА: 98 (65%) амбулаторних та 52 (35%) хворих ревматологічного відділення. Серед пацієнтів було 122 жінки (середній вік – 49,7±9,15 року) та 28 чоловіків (середній вік – 42±8,47 року), 86 мешканців міста та 64 жителя сільської місцевості.
Дизайн дослідження передбачав проведення трьох етапів, які включали:
- дослідження характеру больового синдрому та частоту нейропатичного компонента болю серед хворих на ОА;
- оцінювання поширеності використання НПЗЗ та ступінь обізнаності стаціонарних та амбулаторних хворих стосовно препаратів даної групи;
- порівняльний аналіз клінічної ефективності симптоматичних повільнодіючих препаратів (діацереїн) та симптоматичних препаратів швидкої дії (НПЗЗ) та їхнього впливу на маркери кісткового метаболізму (РІСР та остеокальцин) серед пацієнтів із ОА у поєднанні з ожирінням.
Усі пацієнти отримували терапію згідно з клінічним протоколом надання медичної допомого хворим із ОА (наказ МОЗ України № 676 від 12.10.2006 року), що включав симптоматичний препарат уповільненої дії (діацереїн) та симптом-модифікуючі препарати – нестероїдні протизапальні засоби (НПЗЗ) з групи селективних інгібіторів циклооксигенази-2 (мелоксикам та целекоксиб). Для проведення порівняльного аналізу клінічної ефективності симптоматичних повільнодіючих препаратів та симптоматичних препаратів швидкої дії пацієнти випадковим чином були розподілені на дві групи, співставні за основними демографічними та клінічними характеристиками. Пацієнти основної групи (n=15) отримували діацереїн (препарат Флекцерин, ПАТ «Київський вітамінний завод») за схемою: перші 2 тиж – 50 мг на добу із подальшим підвищенням дози до 100 мг на добу. Використання НПЗЗ допускалося за потребою. Пацієнти групи контролю (n=17) отримували лише НПЗЗ з групи селективних інгібіторів циклооксигенази-2 з виключенням використання модифікувальних препаратів уповільненої дії протягом 3 міс до початку дослідження. Термін спостереження склав 3 міс.
Рівень кісткового метаболізму оцінювали за допомогою кількісного вимірювання рівнів карбоксітермінального пропептиду проколагену І типу (РІСР) (Cloud-Clone Corp. «Procollagen I C-Terminal Propeptide», США) та остеокальцину (Roche Diagnostics «N-MID Osteocalcin», Швейцарія) на аналізаторі «ELECSYS 2010» методом імуноферментного аналізу на початку та наприкінці спостереження. Задля об’єктивізації больового синдрому використовували додаткові шкали: візуально-аналогова шкала (ВАШ) для визначення суб’єктивної оцінки болю на момент дослідження та в динаміці, а також опитувальник з болю (PainDetect Questionnaire – PD-Q; R. Freynhagen et al., 2006) для визначення поширеності нейропатичного компонента болю серед хворих на ОА. Ступінь функціональної здатності суглобів, із розрахунком індексів болю, скутості та рухових обмежень визначали за допомогою розрахунку клініко-функціонального індексу WOMAC (Western Ontario and McMaster Universities Arthritis Index).
Для статистичного аналізу даних було використано дискриптивну статистику з розрахунком середньої величини (М), середньої стандартної помилки (m). Вірогідність різниці оцінювали параметричними (за t-критерієм Стьюдента для непов’язаних виборок) і непараметричними (c2 Пірсона, U- критерій Манна–Уїтні, Колмогорова–Смирнова) методами. Взаємозв’язок між параметрами, які вивчалися, виявляли за допомогою розрахунку коефіцієнта кореляції Спірмена. Усі дані наведені у вигляді середнього та похибки середнього значення. Значущою вважали різницю при р<0,05. Усі розрахунки здійснені у програмі «STATISTICA v.6.1» (StatSoft Inc., ліцензійний номер № AGAR909E415822FA).
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
За даними анкетування 96,7% хворих у якості аналгетичної терапії використовували НПЗЗ, при цьому як джерело інформації про НПЗЗ 87 (60%) хворих зазначили лікаря, 58 (40%) – інші джерела (самостійно, друзі, родичі, сусіди, телевізійна реклама, провізор аптеки) (мал. 1).
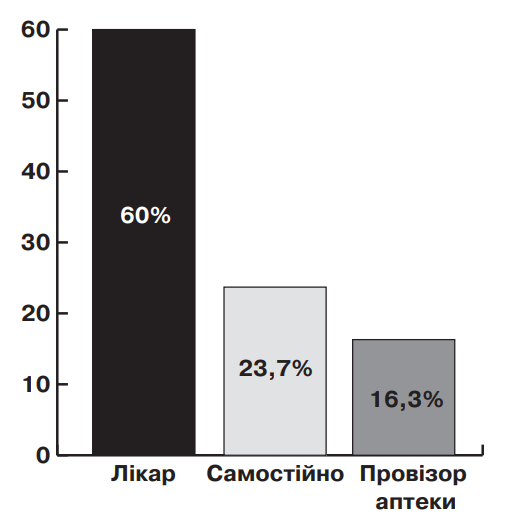
Мал. 1. Джерела інформації про НПЗЗ
Аналіз даних анкетування свідчить, що майже половина хворих – 61 (42,1%) отримували НПЗЗ безрецептурно, без консультації лікаря стосовно доцільності їхнього використання та порад щодо оптимального вибору НПЗЗ, враховуючи стан пацієнта та наявну коморбідну патологію. Оцінка обізнаності хворих стосовно безпеки НПЗЗ продемонструвала майже однаковий розподіл між пацієнтами, які вважають НПЗЗ цілком безпечними препаратами та тими, які із побоюванням відносяться до даного класу препаратів – 47,6% та 52,4% відповідно. При цьому, на думку хворих, небезпечність НПЗЗ характеризується майже однаковим розподілом серед гастро–, кардіо– та нефротоксичністю (мал. 2).
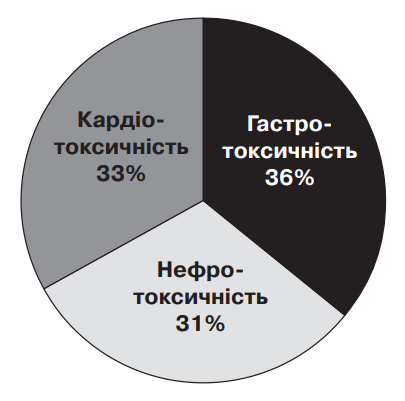
Мал. 2. Спектр небезпечності НПЗЗ на думку пацієнтів
Разом з тим, було продемонстровано, що сільське населення (73,4%) із більшою настороженістю ставиться до препаратів зазначеної групи, визначаючи НПЗЗ, як небезпечний препарат, у той час як серед міського населення лише 45% вважають НПЗЗ небезпечними. Більш високий рівень обізнаності стосовно небезпечності НПЗЗ також було продемонстровано серед хворих із вищою освітою та тих, які перебували на стаціонарному лікуванні. Так, серед хворих із вищою освітою обізнаність стосовно можливих побічних ефектів НПЗЗ була у 1,5 разу вища на відміну від хворих із професійно-технічною освітою (60,9% та 39,1% відповідно), а стаціонарних пацієнтів – майже у 2 рази вища у порівнянні з амбулаторними хворими (65,4% та 34,6% відповідно).
Ймовірність наявності нейропатичного компонента болю визначали за сумарною кількістю балів, що набрав хворий у ході анкетування за опитувальником PD-Q: 0–12 балів – малоймовірний нейропатичний компонент болю (<15%); 13–18 балів можливий нейропатичний компонент болю; 19–38 балів – висока ймовірність нейропатичного компонента болю (>90%).
Згідно отриманих результатів, 35,3% проанкетованих хворих мали малойвірний нейропатичний компонент болю, 26,1% – можливий нейропатичний компонент болю, 38,6% пацієнтів – високу ймовірність нейропатичного компонента болю (мал. 3).
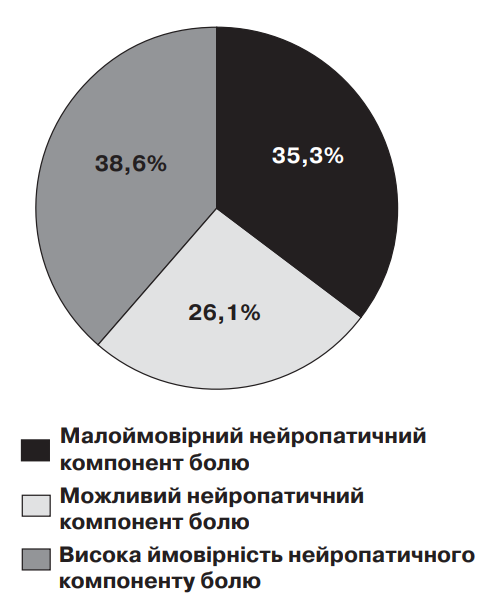
Мал. 3. Ймовірність наявності нейропатичного компонента болю серед хворих на ОА
(опитувальник з болю PD-Q; R. Freynhagen et al., 2006)
Також було продемонстровано, що чоловіки з малоймовірним та можливим нейропатичними компонентами болю мали достовірно більш високий середній бал за опитувальником PD-Q у порівнянні із жінками (табл. 1).
Таблиця 1. Ймовірність наявності нейропатичного компонента болю за опитувальником PD-Q
| Вірогідність нейропатичного компонента болю | Чоловіки | Жінки | р |
| Малоймовірний нейропатичний компонент болю, бали | 9,8±0,91 | 8,7±0,64 | р=0,034 |
| Можливий нейропатичний компонент болю, бали | 16,1±0,64 | 15,1±0,38 | р=0,019 |
| Висока ймовірність нейропатичного компонента болю, бали | 22,4±0,75 | 22,7±0,69 | р>0,05 |
Разом з тим, поширеність використання НПЗЗ як серед пацієнтів із малоймовірним нейропатичним компонентом болю, так і серед хворих із високою ймовірністю нейропатичного компонента болю була високою і склала 80,6% та 76,5% відповідно.
У групу для проведення порівняльного аналізу клінічної ефективності симптоматичних повільнодіючих препаратів (діацереїн) і симптоматичних препаратів швидкої дії (НПЗЗ) та їхнього впливу на маркери кісткового метаболізму (РІСР та остеокальцин) було залучено 32 пацієнта (18 жінок та 4 чоловіка) із моноостеоартрозом І та ІІ стадій за Kellgren та Lawrence. Серед них у 20 (62,5%) хворих було діагностовано ОА колінних суглобів, у 9 (28,1%) – ОА суглобів кистей та у 3 (9,4%) – ОА кульшових суглобів. Більшість склали пацієнти із ОА ІІ стадії – 25 (78,1%), ОА І стадії було діагностовано у 7 (21,9%) хворих. Вік хворих коливався у межах від 46 до 78 років (середній вік – 58,5±1,5 року), середня тривалість захворювання – 10,5±1,2 року. Середній індекс маси тіла (ІМТ) серед хворих, які взяли участь у дослідженні, склав 31,2±1 кг/м2, унаслідок чого було проведено додаткове дослідження у двох субгрупах: у групі хворих на ОА у поєднанні з ожирінням (n=19) та у групі пацієнтів із ОА без ожиріння (n=13).
Клінічну ефективність медикаментозної терапії оцінювали за динамікою інтенсивності больового синдрому у спокої та під час фізичного навантаження, ступенем функціональної здатності суглобів (індекс болю, рухових обмежень та утруднення повсякденної активності), а також динамікою рівнів маркерів кісткового метаболізму (РІСР та остеокальцин) на тлі призначеної терапії.
Згідно зі шкалою ВАШ, середній рівень інтенсивності болю з боку колінних суглобів у спокої та під час фізичного навантаження склав 3,5±0,35 бала та 5,1±0,42 бала відповідно, з боку суглобів інших зон у стані спокою та під час фізичного навантаження – 3,5±0,34 бала та 5,5±0,48 бала відповідно, без достовірної статистичної різниці між зазначеними показниками. При цьому ожиріння у пацієнтів з ОА асоціювалося із достовірно більш високим рівнем болю з боку колінних суглобів (у спокої – р=0,008, під час фізичного навантаження – р=0,032) та при відносній співставності рівнів болю з боку суглобів інших зон (суглоби кистей та кульшові суглоби) (табл. 2).
Таблиця 2. Інтенсивність больового синдрому за шкалою ВАШ серед хворих на ОА залежно від наявності ожиріння
| ВАШ, бали
[min;max] |
Хворі з ОА без ожиріння,
n=13 |
Хворі з ОА у поєднанні
з ожирінням, n=19 |
р |
| Колінні суглоби у спокої | 2,8±0,46
[0;5,0] |
4,2±0,45
[1;8,0] |
р=0,008 |
| Колінні суглоби під час навантаження | 4,2±0,68
[0;8,0] |
5,8±0,47
[1;9,0] |
р=0,032 |
| Суглобів інших зон у спокої | 3,0±0,34
[0;5,0] |
3,5±0,51
[1;8,0] |
н/д (р>0,05) |
| Суглоби інших зон під час навантаження | 5,2±0,83
[0;9,0] |
5,2±0,64
[0;10,0] |
н/д (р=1) |
За індексом WOMAC, середній рівень болю склав 26,9±1,0 бала, рухових обмежень – 8,1±0,33 бала та утруднення повсякденної активності – 81,1±2,13 бала. Разом з тим, серед хворих на ОА у поєднанні з ожирінням, було виявлено достовірно більш високий ступінь рухових обмежень, при відсутності достовірної різниці між рівнем болю та ступенем утруднення повсякденної активності у порівнянні з хворими на ОА без ожиріння (мал. 4).
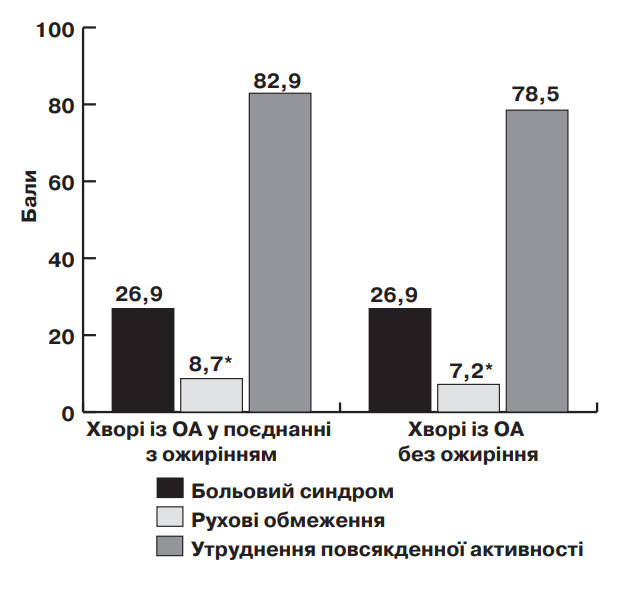 Мал. 4. Функціональний статус хворих на ОА залежно від наявності ожиріння (*р=0,013)
Мал. 4. Функціональний статус хворих на ОА залежно від наявності ожиріння (*р=0,013)
Аналіз початкового рівня кісткового метаболізму за середніми величинами продемонстрував достовірно (р=0,007) вищий рівень остеокальцину серед пацієнтів віком 60–75 років у порівнянні із хворими 40–59 років за відносної співставності рівнів РІСР у групах порівняння (табл. 3).
Таблиця 3. Вікові особливості рівнів маркерів кісткового метаболізму у хворих на ОА
| Маркери кісткового метаболізму | 40v59 років | 60v75 років | р |
| РІСР, пг/мл | 37,56±4,83 | 34,46±8,02 | р>0,05 |
| Остеокальцин, мкг/мл | 21,91±1,54 | 26,54±5,34 | р=0,007 |
Наявність ожиріння у хворих на ОА не асоціювалася із достовірним впливом на рівень кісткового метаболізму, при відносній співставності рівнів РІСР та остеокальцину у хворих на ОА у поєднанні з ожирінням та у хворих на ОА без ожиріння (табл.4).
Таблиця 4. Рівень маркерів кісткового метаболізму у хворих на ОА залежно від наявності ожиріння
| Маркери кісткового метаболізму | Хворі з ОА без ожиріння, n=13 | Хворі з ОА у поєднанні з ожирінням, n=19 |
| РІСР, пг/мл | 35,0±5,6 | 37,0±6,0 |
| [8,7; 78,1] | [6,8; 72,0] | |
| Остеокальцин, мкг/мл | 25,4±3,1 | 21,9±2,3 |
| [14,9; 53,3] | [8,9; 48,7] |
Примітки: р>0,05 – достовірність відмінностей між показниками усередині груп та між групами порівняння.
У ході дослідження було продемонстровано прямопропорційний зв’язок між рівнями РІСР та вираженістю больового синдрому під час фізичного навантаженя з боку суглобів кистей та кульшових суглобів, про що свідчить наявність прямого помірного кореляційного зв’язку (R=0,49; р=0,04) між рівнями наведених вище показників (мал. 5).
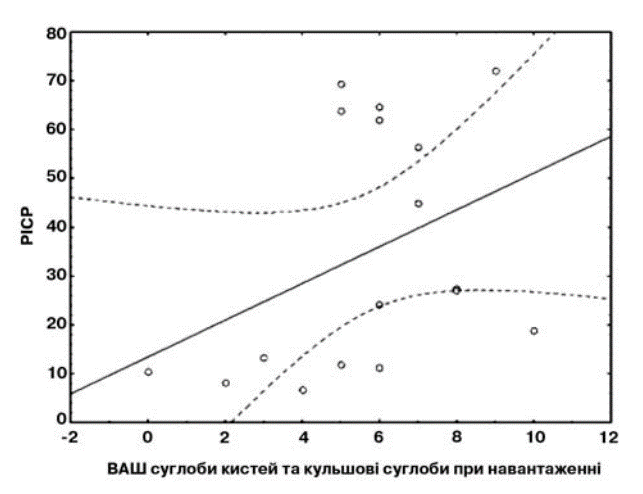 Мал. 5. Кореляційний зв’язок між рівнями інтенсивності больового синдрому при навантаженні з боку суглобів кистей і кульшових суглобів та рівнем РІСР
Мал. 5. Кореляційний зв’язок між рівнями інтенсивності больового синдрому при навантаженні з боку суглобів кистей і кульшових суглобів та рівнем РІСР
Достовірного взаємозв’язку між рівнями маркерів кісткового метаболізму та функціональним станом суглобів виявлено не було.
До кінця 3-го місяця спостереження серед пацієнтів основної групи було досягнуто достовірного зниження інтенсивності больового синдрому як у спокої, так і під час фізичного навантаження, що було продемонстровано у всіх суглобових зонах. Так, найбільш виражений аналгетичний ефект було продемонстровано з боку колінних суглобів, де біль у спокої знизився на 39,5% (р<0,001) та під час фізичного навантажені на 40,4% (р<0,001). Достовірний ефект щодо зменшення болю було виявлено і з боку суглобів кистей та кульшових суглобів, де інтенсивність болю у спокої та під час фізичного навантаженя знизилася на 36,4% (р=0,013) та 35,3% (р=0,014) відповідно (табл. 5).
Таблиця 5. Динаміка інтенсивності больового синдрому за ВАШ серед пацієнтів основної та контрольної груп на початку та наприкінці дослідження
| Інтенсивність больового синдрому за ВАШ, бали [min;max] | На початку дослідження | Наприкінці дослідження | ||
| Основна група, n=15 | Група контролю, n=17 | Основна група, n=15 | Група контролю, n=17 | |
| Колінні суглоби у спокої | 3,8±0,51 | 3,4±0,47 | 2,3±0,28** | 2,5±0,37* |
| [1,0;8,0] | [0;7,0] | [1,0;5,0] | [0;5,0] | |
| Колінні суглоби під час | 5,2±0,49 | 5,1±0,68 | 3,1±0,25** | 3,8±0,57*- |
| навантаження | [1,0;9,0] | [0;9,0] | [1,0;5,0] | [0;8,0] |
| Суглоби кистей та кульшові | 3,3±0,50 | 3,3±0,44 | 2,1±0,29* | 2,6±0,40 |
| суглоби у спокої | [0;8,0] | [0;8,0] | [0;5,0] | [0;6,0] |
| Суглоби кистей та кульшові | 5,1±0,72 | 5,3±0,72 | 3,3±0,46** | 4,1±0,65 |
| суглоби піж час навантаження | [0;9,0] | [0;10,0] | [0;6,0] | [0;9,0] |
Примітки: * р<0,05, **р<0,001 – достовірність відмінностей між показниками усередині груп порівняння,
-р<0,05 – достовірність відмінностей показників між групами порівняння.
Натомість серед пацієнтів групи контролю достовірний аналгетичний ефект було відзначено лише по відношенню зменшення інтенсивності болю з боку колінних суглобів, де біль у стані спокою та під час фізичного навантаження знизився на 26,5% (р=0,026) та 25,5% (р=0,04) у порівнянні із вихідними рівнями. У той самий час достовірного зменшення інтенсивності больового синдрому з боку суглобів кистей та кульшових суглобів не було продемонстровано (див. табл. 5). Було зазначено, що терапія діацереїном упродовж 3 міс сприяє більш вираженому аналгетичному ефекту з боку колінних суглобів щодо зменшення болю під час фізичного навантаження, який наприкінці періоду спостереження був на 18,4% нижчим у порівнянні з хворими, які отримували НПЗЗ (р=0,02) (див. табл. 5).
Наявність ожиріння у хворих на ОА не впливала на розвиток аналгетичного ефекту, який був достовірним як серед пацієнтів на ОА без ожиріння, так і серед хворих на ОА у поєднанні з ожирінням. При цьому максимальний аналгетичний ефект був відзначений серед пацієнтів із ОА без ожиріння з боку колінних суглобів, де біль у спокої знизився на 54,3% (р<0,001), біль під час фізичного навантаження – на 51,7% (р<0,001 ) у порівнянні з вихідним рівнем (табл. 6).
Таблиця 6. Динаміка інтенсивності больового синдрому серед пацієнтів із ОА залежно від наявності ожиріння на початку та наприкінці дослідження
| Інтенсивність больового синдрому за ВАШ, бали[min;max] | На початку дослідження | Наприкінці дослідження | ||
| Хворі на ОА у поєднанні
з ожирінням, n=19 |
Хворі на ОА без
ожиріння, n=13 |
Хворі на ОА у поєднанні
з ожирінням, n=19 |
Хворі на ОА без
ожиріння, n=13 |
|
| Колінні суглоби у спокої | 4,2±0,45 | 2,8±0,46 | 2,7±0,30*** | 1,9±0,33*- |
| [1;8,0] | [0;5,0] | [1,0;5,0] | [0;4,0] | |
| Колінні суглоби під час | 5,8±0,47 | 4,2±0,68 | 4,0±0,38*** | 2,8±0,51*- |
| навантаження | [1;9,0] | [0;8,0] | [1,0;8,0] | [0;6,0] |
| Суглоби кистей та кульшові | 3,5±0,51 | 3,0±0,34 | 2,4±0,34** | 2,4±0,38 |
| суглоби у спокої | [1;8,0] | [0;5,0] | [0;6,0] | [0;6,0] |
| Суглоби кистей та кульшові
суглоби піж час навантаження |
5,2±0,64
[0;10,0] |
5,2±0,83
[0;9,0] |
3,9±0,58
[0;9,0] |
3,4±0,55** [0;6,0] |
Примітки: * – р<0,05, **р<0,01, ***р<0,001 – достовірність відмінностей між показниками всередині груп порівняння;
– р<0,05 – достовірність відмінностей показників між групами порівняння.
На тлі достовірного аналгетичного ефекту у ході дослідження було також продемонстровано достовірне покращення функціонального стану суглобів за індексом WOMAC серед пацієнтів обох груп спостереження (табл. 7).
Таблиця 7. Динаміка функціонального стану суглобів серед пацієнтів основної групи та групи контролю у ході дослідження
| Функціональний стан хворих на ОА за шкалою WOMAC, бали [min;max] | На початку дослідження | Наприкінці дослідження | ||
| Основна група, n=15 | Група контролю, n=17 | Основна група, n=15 | Група контролю, n=17 | |
| Больовий синдром | 26,4±0,89 | 27,3±1,82 | 18,4±0,87*** | 21,6±1,85**- |
| [21;31] | [11;42] | [13;25] | [9,0;33] | |
| Рухові обмеження | 7,4±0,40 | 8,6±0,50 | 5,1±0,37*** | 7,4±0,59*– |
| [5;9,0] | [6;12,0] | [3;7,0] | [4,0;11,0] | |
| Утруднення повсякденної | 83,2±2,15 | 78,8±3,64 | 61,1±2,1*** | 64,5±3,61** |
| активності | [69;98] | [37;98] | [51;76] | [36;95] |
Примітки: *р<0,05, **р<0,01, ***р<0,001 – достовірність відмінностей між показниками усередині основної групи та групи контролю;
– р<0,01, -р<0,001 – достовірність відмінностей показників між групами порівняння.
Так, на 3-у місяці спостереження серед пацієнтів основної групи рівень больового синдрому знизився на 30,3% (р<0,001), ступінь рухових обмежень та утруднення повсякденної діяльності на 31,1% та 26,6% відповідно (р<0,001) у порівняння з вихідним рівнем. Аналогічна тенденція була продемонстрована і серед пацієнтів групи контролю, де рівень болю знизився на 20,9% (р<0,01), ступінь рухових обмежень та утруднення повсякденної діяльності на 14% (р<0,05) та 18,1% (р<0,01) відповідно у порівнянні з початковими рівнями.
Порівняльний аналіз функціональної здатності суглобів наприкінці дослідження продемонстрував достовірно більш ефективне зниження ступеня рухових обмежень серед пацієнтів, що отримували діацереїн, яке на кінець періоду спостереження було на 31,1% нижчим (р=0,0016), ніж серед пацієнтів, які отримували НПЗЗ (5,1±0,37 бала vs 7,4±0,59 бала відповідно) при відносній порівнянності результатів щодо зниження больового синдрому та утруднення повсякденної діяльності (табл. 7).
Наявність ожиріння у хворих на ОА спричинює достовірне зниження клінічної ефективності терапії щодо покращення функціонального стану суглобів. Так, рівні ступеня рухових обмежень та утруднення повсякденної активності за шкалою WOMAC наприкінці дослідження були на 25,3% (р=0,0031) та на 10,5% (р=0,031) вищими серед пацієнтів із ОА у поєднанні з ожирінням, ніж у хворих на ОА без ожиріння.
Терапія діацереїном упродовж 3 міс була асоційована із достовірним клінічним ефектом у вигляді зменшення больового синдрому та покращення функціональної здатності суглобів у хворих основної групи на тлі тенденції до зниження рівня РІСР на 16,3% (р>0,05) та майже стабільному рівні остеокальцину (табл. 8).
Таблиця 8. Динаміка маркерів кісткового метаболізму серед пацієнтів обох груп у ході дослідження
| Динаміка маркерів кісткового метаболізму[min;max] | На початку дослідження | Наприкінці дослідження | ||
| Основна група,
n=15 |
Група контролю,
n=17 |
Основна група,
n=15 |
Група контролю,
n=17 |
|
| РІСР, пг/мл | 42,9±5,6 | 30,8±5,68- | 35,9±6,7 | 30,8±5,38 |
| [11,0;78,1] | [6,8;72,0] | [2,3;66,5] | [4,1;70,6] | |
| Остеокальцин, мкг/мл | 19,0±1,56 | 27,2±3,1– | 18,2±1,63 | 23,0±1,72- |
| [12,9;30,8] | [8,9;53,3] | [11,6;38,3] | [11,6;37,9] | |
Примітки: р<0,05, -р<0,001 – достовірність відмінностей показників між основною групою та групою контролю.
Відсутність достовірної динаміки щодо рівнів маркерів кісткового метаболізму була також продемонстрована і серед пацієнтів групи контролю, але була відзначена інша тенденція – стабільність рівнів РІСР на тлі зниження рівня остеокальцину (на 15,4% порівняно з вихідним значенням, р>0,05). При цьому рівень остеокальцину наприкінці періоду спостереження серед пацієнтів основної групи був достовірно нижчим у порівнянні із хворими групи контролю (18,2±1,63 мкг/мл та 23,0±1,72 мкг/мл, р=0,011), при відносній співставності результатів за кінцевими рівнями РІСР (35,9±6,7 пг/мл та 30,8±5,38 пг/мл відповідно, р>0,05) (див. табл. 8).
Проте оцінка динаміки рівнів РІСР та остеокальцину протягом періоду спостереження не продемонструвала достовірної динаміки у жодній з вікових груп незалежно від отримуваної терапії (табл. 9).
Таблиця 9. Динаміка маркерів кісткового метаболізму у хворих на ОА залежно від віку
|
Вік хворих на ОА |
На початку спостереження | Наприкінці спостереження | ||
| РІСР,
пг/мл |
Остеокальцин,
мкг/мл |
РІСР,
пг/мл |
Остеокальцин,
мкг/мл |
|
| 40659 років | 31,1±6,89 | 24,1±2,42 | 30,9±7,30 | 23,3±2,16 |
| 60675 років | 30,2±11,25 | 34,2±7,97 | 30,5±7,35 | 22,5±3,10 |
Примітки: р>0,05 – достовірність відмінностей між показниками усередині груп та між групами порівняння.
Таким чином, висока поширеність використання НПЗЗ серед хворих на ОА, як засобів боротьби із больовим синдромом на тлі значного відсотка безрецептурного використання препаратів даної групи та недостатньої обізнаності хворих стосовно можливих побічних ефектів при використання НПЗЗ зумовлюють актуальність оцінювання доцільності використання НПЗЗ з точки зору превалюючого патогенетичного компонента болю та можливості впливу на нього.
За результатами, отриманими у ході дослідження, було продемонстровано вплив ожиріння на інтенсивність больового синдрому з боку колінних суглобів та ступінь рухових обмежень у разі відсутності впливу на рівні маркерів кісткового метаболізму.
Одночасно була показана значущість РІСР та ОК, як маркерів кісткового синтезу, що здатні відображати процеси метаболізму у СХК при ОА. Рівні РІСР та ОК не виявили достовірної залежності від наявності ожиріння та віку хворих і не корелювали зі ступенем функціональної здатності суглобів.
Порівняльний аналіз клінічної ефективності препаратів групи SYSADOA (діацереїн) та НПЗЗ продемонстрував більш виражений аналгетичний ефект діацереїну, якого було досягнуто у всіх суглобових зонах, та переваги даної групи препаратів відносно покращення функціональної здатності суглобів. Зазначені клінічні переваги симптоматичних повільнодіючих препаратів також асоціювалися із підтриманням відносної стабільності рівнів маркерів кісткового метаболізму упродовж періоду спостереження, що може свідчити про рівновагу процесів остеосинтезу та деструкції на тлі компенсаторної достатності репараційних процесів у СХК. Разом з тим, використання НПЗЗ у хворих на ОА супроводжувалося менш вираженим аналгетичним ефектом, який було відзначено лише з боку колінних суглобів та тенденцією до зниження рівня ОК, що може бути розцінено як показник пригнічення остеосинтезу із превалюванням катаболічних процесів у СХК.
Отримані результати дозволяють припустити відсутність катаболічного впливу препаратів SYSADOA на СХК. Про це свідчить відсутність достовірної динаміки маркерів кісткового метаболізму протягом дослідження. У той самий час достовірне зниження рівня ОК при використанні НПЗЗ може бути розцінено як показник пригнічення остеосинтезу із переважанням катаболічних процесів у СХК. Дана перевага може бути перспективною з точки зору подальшого дослідження стану СХК та спроможності базових препаратів при ОА впливати на процеси метаболізму кісткової тканини у хворих на ОА.
Результати даного дослідження можуть мати певні обмеження, що зумовлено невеликою кількістю хворих у групах та нетривалим періодом спостереження.
ВИСНОВКИ
- Больовий синдром у хворих на остеоартрит (ОА) є однією з мішеней медикаментозної терапії. Разом з тим, нейропатичний біль є досить поширеним серед хворих на ОА та, за результатами даного дослідження, зустрічається у 64,7% хворих, що водночас асоціюється із недостатньою обізнаністю пацієнтів щодо можливих ризиків при використані нестероїдних протизапальних засобів (НПЗЗ) та значним відсотком (40%) отримання інформації стосовно даної групи препаратів із додаткових джерел, окрім лікаря.
- У ході дослідження не було продемонстровано залежності між рівнями маркерів кісткового метаболізму (карбокситермінальний пропептид проколлагену 1 типу – РІСР та ОК – остеокальцин) та наявністю ожиріння при достовірно вищому рівні остеокальцину серед пацієнтів у віковій групі 60–75 років та відсутністю достовірних вікових відмінностей з боку рівня РІСР. Медикаментозне лікування діацереїном (препарат Флекцерин, ПАТ «Київський вітамінний завод») зумовлювало стабільність рівня ОК у разі відсутності достовірної динаміки рівня РІСР, що може свідчити про компенсаторну достатність репараційних процесів у СКХ на відміну від ізольованого використання НПЗЗ, де пріоритетні зміни було продемонстровані щодо зниження рівня ОК.
- Медикаментозне лікування з використанням препарату Флекцерин зумовлювало додаткові позитивні ефекти щодо зональної поширеності аналгетичного ефекту та покращення функціональної здатності суглобів, у порівнянні з ізольованим використанням НПЗЗ, де достовірний аналгетичний ефект було досягнуто лише з боку колінних суглобів при достовірно менш вираженому покращенні функціональної здатності суглобів щодо зниження рівня рухових обмежень.
- Ожиріння у хворих на ОА асоціювалося із достовірним підвищенням інтенсивності больового синдрому з боку колінних суглобів та вищим ступенем рухових обмежень, зумовлюючи разом з тим зниження клінічної ефективності терапії щодо досягнення аналгетичного ефекту та покращення функціональної здатності суглобів.
Сведения об авторах
Курята Александр Викторович – Кафедра внутренней медицины №2 ГУ «Днепропетровская медицинская академия МОЗ Украины», 49044, г. Днепр, ул. Вернадского (Дзержинского), 9; тел.: (056) 713153134, (056) 765195129. E-mail: [email protected], gt1@ dsma.dp.ua
Черкасова Анна Валентиновна – Кафедра внутренней медицины №2 ГУ «Днепропетровская медицинская академия МОЗ Украины», 49044, г. Днепр, ул. Вернадского (Дзержинского), 9; тел.: (056) 713153134, (056) 765195129. E-mail: [email protected]
СПИСОК ЛІТЕРАТУРИ
-
- Anyonya Guntur, Clifford J. Rosen. Bone as Endocrine organ / R. Anyonya Guntur, J. Rosen // Endocr Pract. – 2012. – Vol. 18 (5). – P. 758–762.
- Cherkasova A. Kuryata O. The markers of bone metabolism and systemic inflammation in patients with osteoarthritis depending on body mass, the influence of symptomatic slow acting drugs / A. Cherkasova, O. Kuryata // EUREKA: Health Sciences. – 2016. – № 5. – P. 3–12.
- Couchourel D. Altered mineralization of human osteoarthritic osteoblasts is attributable to abnormal type I collagen production / D. Couchourel // Arthritis Rheum. – 2009. – Vol. 60. – P. 1438–1450.
- Csifo E., Katona T., Arseni J. [et al.]. Correlation of serum and synovial osteocalcin, osteoprotegrin and tumor necrosis factor-alfa with the disease severity score in knee osteoarthritis / E. Csifo, T. Katona, J. Arseni et al. // Acta Medica Marisiensis. – 2014. – Vol. 60 (3). – P. 102–105.
- Fernandes L., Hagen K. B., Bijlsma J. W., Andreassen O., Christensen P., Conaghan P. G. et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis / L. Fernandes, K.B. Hagen, J.W. Bijlsma, O. Andreassen,
P. Christensen, P.G. Conaghan et al. // Ann Rheum Dis. 2013; 72: 1125–1135. - Gwilym S.E., Keltner J.R., Warnaby
C.E. et al. Psychophysical and functional imaging evidence supporting the presence of central sensitization in a cohort of osteoarthritis patients / S.E. Gwilym, J.R. Keltner, C.E. Warnaby et al // Arthritis Rheum. – 2009. – Vol. 61 (9). – P. 1226–1234. - Hochberg M.C. American College of Rheumatology 2012 recommendation for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee / C. Hochberg // Arthritis Care Res (Hoboken), 2012 . – Apr;Vol. 64 (4). – Р. 465–474.
- Leila C.B. Zanatta, Cesar L. Boguszewski, Victoria Z.C. Borba, Carolina M. Kulak Osteocalcin, energy and glucose metabolism / C.B. Leila Zanatta, L. Cesar Boguszewski, Z.C. Victoria Borba, A.M. Carolina Kulak // Arq Bras Endocrinol Metab. – 2014. – Vol. 58 (5). – P. 444–451.
- Lotz M., Pelletier M., Christiansen C. et al. Value of biomarkers in osteoarthritis: current status and perspectives / M. Lotz, M. Pelletier, C. Christiansen et al. // Ann Rheum Dis. – 2013. – doi:10.1136/annrheumdis-2013-203726
- McAlindon T.E. OARSI guidelines for the non-surgical management of knee osteoarthritis / E. McAlindon // Osteoarthritis and Cartilage/OARS, Osteoarthritis Research Society, 2014. – Vol. 22, Issue 3, Pages 363–388
- Rousseau J., Garnero P. Biological markers in osteoarthritis / J. Rousseau, P. Garnero // Bone. – 2012. – Vol. 51. – P. 265–277.
- Головач І.Ю. Оцінка нейропатичного болю у пацієнтів із хронічним суглобовим синдромом / І.Ю. Головач, Т.М. Чіпко, І.П. Семенів, О.М. Авраменко, О.О. Лазоренко // Український ревматологічний журнал. – № 2 (60). – 2015 – С. 64–69.
- Долгова Е.А. Биомаркеры остеоартрита (обзор литературы) / Е.А. Долгова, В.Н. Сороцкая, Д.Р. Ракита // Вестник новых медицинских технологий. – 2012 – Т. XIX, № 1. – С. 227–230.
- Журавльова Л.В. Сучасний погляд на лікування остеоартрозу, як хронічного запального захворювання / Л.В. Журавльова, М.О. Олійник // Ліки України Плюс. – 2015. – № 3 (24). – С. 9–12.
- Курята А.В. Инсулинорезистентность и системное воспаление у пациентов с остеоартрозом в сочетании с ожирением: эффективность симптоматических препаратов замедленного действия / А.В. Курята, А.В. Черкасова // Травма. – 2016 – № 1 (17). – С. 47–54.
- Курята А.В. Клиническая эффективность и динамика системного воспаления у пациентов с остеоартрозм; влияние ожирения / А.В. Курята, А.В. Черкасова // Сімейна медицина. – 2015. – № 5 (61). – С. 171–180.
- Нетюхайло Л.Г. Метаболізм кісткової тканини в нормі та при патології (огляд літератури) / Л.Г. Нетюхайло, Л.К. Іщейкіна // Молодий вчений. – 2014. – № 6 (09). – С. 152–158.
- Поворознюк В.В. Нейропатичний компонент болю при захворюваннях кістково-м’язової системи: огляд літератури та результати власних досліджень. Ч. / В.В. Поворознюк, Т.Є. Шинкаренко, У.І. Приймич // Боль. Суставы. Позвоночник,. – 2014. – 4 (16). – С. 5–13.
- Саковец Т.Г. Особенности нейропатической боли при поражении суставов / Т.Г. Саковець// Практ. Медицина. – 2014 – 4 (80). – С. 103–106.
- Семенів І.П. Частота діагностики нейропатичного компонента больового синдрому у пацієнтів з остеоартрозом колінних суглобів / Семенів І.П., І.Ю. Головач, Т.М. Чіпко та ін. // Укр. ревматол. журн. – 2012 – 1 (47). – С. 68–71.
- Туровская Е.Ф. Дисфункциональные механизмы хронического болевого синдрома у пациентов с остеоартрозом / Е.Ф. Туровская, Е.Г. Филатова, Л.И. Алексеева //Лечение заболеваний нервной системы. – 2013 – № 1 (11). – С. 21–28.
- Чичасова Н.В. Лечение хронических заболеваний суставов / Н.В. Чичасова //Совр. ревматология. – 2012 – № 2. – С. 89–98.
- Шуба Н.М. Вивчення ефективності структурно-модифікуючих препаратів у хворих на гонартроз / Н.М. Шуба, Т.Д. Воронова, А.С. Крилова, Г.В. Данішевська // Ліки України. – № 4 (190). – С. 66–69.
Статья поступила в редакцию 18.11.2016
Стаття надана мовою оригіналу






